Интерес к монозамещенным борным кислотам и их эфирам связан с особенностями строения, обусловленными наличием частично двойной В-О связи, и комплексом практически полезных свойств [1-6]. Ранее методами рентгеноструктурного анализа [7,8], микроволновой спектроскопии [9], дифракции электронов [10,11] и дипольных моментов [12-14] было показано, что поверхность потенциальной энергии (ППЭ) монозамещенных борных кислот и их эфиров содержит в качестве главного минимума планарный цис-транс-конформер (I); концентрация менее стабильных планарных форм транс-транс- (II) и цис-цис- (III) незначительна.
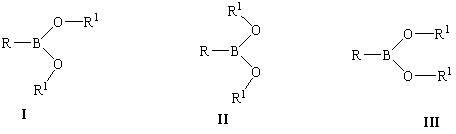
Эти данные были подтверждены ab initio расчетами энергии и геометрии конформеров диоксиборана (R = R1 = H) [15]. Настоящая работа посвящена изучению путей конформационной изомеризации метилборной кислоты, CH3B(OH)2, с помощью полуэмпирического (АМ1) и неэмпирических [RHF//STO-3G, 3-21G, 6-31G(d) и 6-311G(d,p)] квантово-химических приближений в рамках пакета HyperChem [16] в условиях, моделирующих поведение молекул этого вещества в газовой фазе.
Нами установлено, что ППЭ исследуемого соединения содержит три минимума (конформеры I-III), и два максимума, отвечающих ортогональным формам IV и V.
Таблица 1. Расчетные энергетические параметры конформационной изомеризации метилборной кислоты (ккал/моль)
|
Параметры* |
Базисы (метод RHF) |
||||
|
АМ1 |
STO-3G |
3-21G |
6-31G(d) |
6-311G(d,p) |
|
|
∆EII ∆EIII ∆EII≠ ∆EIII≠ |
4.2 3.5 11.6 9.1 |
2.7 3.1 15.0 13.6 |
4.9 3.3 11.2 8.6 |
3.2 3.2 11.5 9.8 |
3.0 3.0 10.9 9.4 |
*) Относительно конформера I
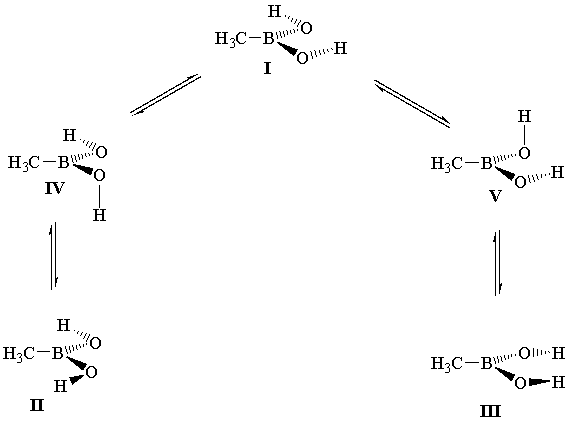
Параметры конформационной изомеризации, представленные в таблице, свидетельствуют о том, что главному минимуму на ППЭ отвечает цис-транс-форма I. Конформеры II и III соответствуют локальным минимумам и менее стабильны на 3-4 ккал/моль (∆EII и ∆EIII). Наиболее высокий потенциальный барьер конформационной изомеризации, вне зависимости от расчетного базиса, лежит на пути превращения формы I в конформер II (∆EII≠) и отвечает ортогональной форме IV. Вместе с тем усложнение базиса расчета (за исключением результатов 3-21G) приводит к сближению стационарных точек IV и V (∆EII≠ и ∆EIII≠); параллельно этому наблюдается и сближение энергетических уровней форм II и III, которые в приближениях 6-31G(d) и 6-311G(d,p) оказываются вырожденными по энергии.
Необходимо также отметить, что расчетные значения потенциальных барьеров конформационной изомеризации, полученные в приближениях 6-31G(d) и 6-311G(d,p), в целом достаточно близки к экспериментальным результатам измерения барьера вращения вокруг связи В-О в диметилборном ангидриде (8.5 ккал/моль, ЯМР 1H [17]), димезитилметоксиборанах (12.6-13.7 ккал/моль, ЯМР 1H [18] и 13С [19]), а также в диметилметоксиборане (8.9 ккал/моль, ЯМР 13С [20]). Расхождение расчетных и экспериментальных результатов можно объяснить различием в строении сравниваемых молекулярных фрагментов: с одной стороны это С-В(ОR)2, а с другой - С2В-OR. В этой связи следует особо подчеркнуть полное совпадение данных, полученных при использовании базиса 6-311G(d,p) (9.4 ккал/моль) с экспериментом для мезитилдиметоксиборана (9.4 ккал/моль [18]), поскольку в данном случае речь идет об одинаковом окружении атома бора [фрагмент С-В(ОR)2]; другими словами, учитывается электронное влияние второго атома кислорода, связанного с бором.
Таким образом, анализ конформационных превращений метилборной кислоты дает основание полагать, что преобладающей формой молекул этого соединения в газовой фазе является цис-транс-конформер I.
СПИСОК ЛИТЕРАТУРЫ:
- Ferrier R.J. Methods in Carbohydrate Chemistry. New York-London, 1972. V.6. P.419.
- Carlsohn H., Hartmann M. // Acta Polymerica. 1979. V. 30. N 7. P.420.
- Kliegel W. // Die Pharmazie. 1972. V.27. N 1. P.1.
- Matteson D.S., Soloway A.H., Tomlinson D.W., Campbell J.D., Nixon G.A. // J. Med. Chem. 1964. V.7. N 9. P.640.
- Caujolle F., Chanh P.H., Maciotta J.C. // Agressologie. 1969. V.10. N 2. P.155.
- Несмеянов А.Н., Соколик Р.А. Методы элементоорганической химии. Бор, алюминий, галлий, индий, таллий. М.: Наука, 1964. 499 с.
- Rettig S.J., Trotter J. // Can. J. Chem. 1977. V.55. N.12. P.3071.
- Звонкова З.В., Глушкова В.И. // Кристаллография. 1958. Т.3. Вып.5. С.559.
- Kawashima Y., Takeo H., Matsumura C. // J. Mol. Spectroscopy. 1979. V.78. N.3. P.493.
- Gundersen G., Jonvik T., Seip R. // Acta Chem. Scand. 1981. V.A35. N 5. P. 325.
- Gundersen G. // Kem. Közlem. 1978. V.49. N.2. P.261.
- De Moor J.E., Van Der Kelen G.P. // J. Organometal. Chem. 1967. V.9. N.1. P.23.
- Exner O., Jehlička V. // Coll. Chech. Chem. Comm. 1972. V.37. N.10. P.2169.
- Lumbroso H., Grau A. // Bull. Soc. Chim. France. 1961. N.5. P.1866.
- Fjeldberg T., Gundersen G., Jonvik T., Seip H.M., Saebo S. // Acta Chem. Scand. 1980. V.A34. N.8. P.547.
- HyperChem 7.01. Trial version. http://www.hyper.com/.
- Lanthier G.F., Graham W.A.G. // J. Chem. Soc. Chem. Commun. 1968. N 13. P.715.
- Finocchiaro P., Gust D., Mislow K. // J. Am. Chem. Soc. 1973. V.95. N 21. P.7029.
- Brown N.M.D., Davidson F., Wilson J.W. // J. Organometal. Chem. 1981. V.210. N 1. P.1.
- Stampf E.J., Odom J.D., Saari S.V., Kim Y.H., Bergana M.M., Durig J.R. // J. Mol. Struct. 1990. V.239. P.113.



