стоящей работе исследовали локализацию и активность NADPH-d репродуктивной системы самцов крыс в норме, а также при воздействии неблагоприятных факторов (стресс, алкогольная и марганцевая интоксикация) в условиях острого и хронического эксперимента.
Исследование выполнено на 18 грызунах (самцы белых крыс линии Wistar в возрасте 3-5 месяцев с массой тела 200 - 250г), разделённых на 6 групп и подвергнутых воздействию: а) острого (3) и хронического (3) холодового стресса (20º, 20 мин. однократно, а также ежедневно в течение 10 дней); б) острой (3) и хронической (3) алкогольной интоксикации (интрагастральное введение 20% этанола в дозе 9 г/кг - однократно, а также ежедневно в течение 14 дней); в) острой (3) и хронической (3) марганцевой интоксикации (интраперитонеальное введение хлорида марганца в дозе 150 мг/кг - однократно, а также ежедневно в течение 14 дней). В качестве контроля использовали трёх животных того же возраста и массы. Эксперименты проведены в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Предварительно анестезированных животных, забивали декапитацией. Исследовали крупноклеточные ядра переднего гипоталамуса, тораколюмбальный отдел спинного мозга, половые органы. На криостатных срезах проводили гистохимическую реакцию по выявлению NADPH-d (Hope, Vincеnt; 1989). Часть срезов докрашивали по Нисслю, квасцовым кармином. Метрические параметры NADPH-реактивных нейронов оценивали с применением видеокомпьютерной системы (микроскоп Carl Zeiss, компьютер Duron 750 Mb, графический редактор Jasc Paint Shop Pro 6.00, программа IMAGE PROCESSING TOOLBOX пакета MATLAB R12 version 6.0.88 (Mathworks, Inc) с применением ранговой и медианной фильтрации. Относительное количество NADPHреактивных нейронов, оптическую плотность продукта гистохимической реакции выражали в % и условных единицах оптической плотности (ЕОП) соответственно. Математическая обработка полученных результатов проводилась методами вариационной статистики на компьютере IBM PC/АТ с использованием профильного программного пакета GB STAT GRAPHIC.
Гипоталамус. В ядрах переднего гипоталамуса содержится различное количество (от 1-2 до 50%) нейронов, обладающих активностью NADPH-d. В отделах, содержащих низкое число клеток, они представлены крупными нейронами веретеновидной или полигональной формы с очень высокой активностью фермента. Продукт гистохимической реакции плотно заполняет цитоплазму, окрашивая её в интенсивно тёмносиний цвет. На этом фоне иногда определяются контуры ядра, а также, в единичных нейронах, вакуоли и деформация клеточных тел. Преципитат, образующийся при гистохимической реакции, отчётливо маркирует несколько отростков нейронов на значительном протяжении. Отростки, как правило, имеют умеренно ветвящуюся или прямолинейную форму. NADPH-d, в виде густой сети, маркирует дистальные сегменты отростков нервных клеток с многочисленными синаптическими бляшками. При этом активность фермента по ходу отростков ниже, чем в синаптических бляшках. Активность фермента выявляется также в стенке сосудов, распределение продукта гистохимической реакции неравномерно в сосудах резистивного звена, где отмечается преимущественно продольная «исчерченность». Обменные микрососуды маркируются слабо (рис.1а). Вторым типом нейронов переднего гипоталамуса, обладающих активностью NADPHd, являются клетки со средней и низкой степенью активности фермента. Размеры клеток меньше, но их количество может достигать половины числа нейронов, формирующих ядро. Гранулы диформазана, оставляя свободной область ядра, бледно окрашивают цитоплазму и короткие отрезки проксимальной части отростков. Нейропиль в таких ядрах не содержит интенсивно окрашенной сети отростков нейронов, вместе с тем более интенсивно диффузно окрашен (рис.1б). Эпендима желудочков мозга обладает низкой активностью NADPH. В белом веществе активность фермента самая низкая.
Спинной мозг. Тораколюмбальный отдел спинного мозга крысы отличается высокой активностью NADPH-диафоразы задних и боковых рогов. Низкая и средняя активность фермента наблюдается в мотонейронах центральных и латеральных ядер передних рогов. В боковых рогах активностью обладают нейроны крупных размеров, полигональной формы. Гранулы формазана интенсивно окрашивают отростки нейронов на значительном протяжении боковых канатиков. Гомогенное отложение продуктов гистохимической реакции отмечается и в нейропиле латеральных ядер спинного мозга (рис. 1в).
Интрамуральные микроганглии половых органов. В клетчатке, наружной оболочке простаты, семенных пузырьков с постоянством обнаруживаются интрамуральные микроганглии, включающие в себя от 8 до нескольких десятков нейронов. Нейроны имеют крупные, средние и малые размеры с преобладанием двух последних. Среднее количество NADPH-позитивных нейронов в микроганглиях составляет 57% (рис.1г).
Периферические нервные элементы. Высокая активность фермента обнаружена в нервах наружных половых органов. В составе нервных стволов встречаются широкие лентовидные NADPH-позитивные волокна и узкие, умеренно извитые. Активность фермента, как правило, высокая (рис.1д). Умеренная активность фермента отмечается в клетках Лейдига яичек, низкой активностью обладают эпителий мочевыводящих путей, эпителий протоков и концевых отделов предстательной железы и семенных пузырьков.
Половой член. Кавернозные тела представлены сосудами синусоидного типа, состоящими из трабекул, сформированных гладкомышечными клетками и соединительнотканными элементами. Наружный отдел кавернозных тел сформирован в виде слоя гладкомышечных клеток, ориентированных циркулярно и перпендикулярно продольной оси полового члена. Они обладают высокой активностью NADPH-d. Границы клеток плохо различимы, ядра имеют крупные размеры. Продукт гистохимической реакции выявляется в цитоплазме клеток, а также внеклеточно, интенсивно окрашивая межклеточные пространства. В то же время, активность NADPH-d в клетках стенок синусоидных сосудов относительно низкая (рис.1е). Высокой активностью NADPH-d обладают базальные эпидермоциты кожи полового члена.
В экспериментальных исследованиях изменения активности NADPH-d и количества NADPH-позитивных нейронов носят однонаправленный характер и выражается в увеличении метрических параметров (рис.2). Под влиянием острого холодового стресса наблюдается увеличение активности NADPH-d нейронов гипоталамуса, боковых рогов спинного мозга, а также нейронов вегетативных ганглиев. При этом относительное количество нейронов изучаемых отделов увеличивается недостоверно (Р>0.5), а активность фермента достоверно (Р<0.001). Под действием хронического стресса увеличение числа нейронов и активности фермента было недостоверным (Р>0.5). Острая алкогольная и марганцевая интоксикация также вызывали недостоверное увеличение числа NADPH-позитивных нейронов и активности энзима (Р>0.5). Хроническая алкогольная и марганцевая интоксикация приводила к достоверному увеличению числа NADPHпозитивных нейронов и активности фермента (Р<0.001). Обсуждая роль и значение установленных в настоящем исследовании закономерностей, можно сделать вывод о широком представительстве NADPH-реактивных структур во всех звеньях рефлекторной цепи регуляции половых функций самцов крыс. Можно отметить превышение количества NADPH-реактивных нейронов в вегетативных центрах по сравнению с неокортексом и спинальными ядрами передних рогов, а также высокий уровень ферментативной активности в нервных клетках периферических вегетативных ганглиев, нервных волокнах половых органов, гладкомышечных клетках кавернозных тел. Факт тесной взаимосвязи NADPH-d с циклом превращений NO в организме позволяет обсудить возможную роль и значение выявленного увеличения активности фермента под воздействием неблагоприятных факторов. Известно [3, 4, 5, 19], что активность таких ферментов, как ксантиноксидаза и NADPH-d, обусловливает синтез супероксида, в то время как моноксид азота синтезируется различными формами нитроксидсинтазы. В свою очередь, взаимодействие NO и супероксидного аниона может оказывать двоякое действие, как цитопротективное, так и проапоптотическое. Конечный результат воздействия высокотоксичного пероксинитрита на ткани будет зависеть от количества восстановленного глутатиона в клетках и его способности предотвращать окислительный стресс.
Очевидно, что половые дисфункции, возникающие под влиянием целого ряда неблагоприятных факторов (стресс, алкогольная и наркотическая интоксикация) имеют тесную связь с метаболизмом NO в организме. Они могут носить функциональный характер и становиться необратимыми патологическими при определённых условиях.
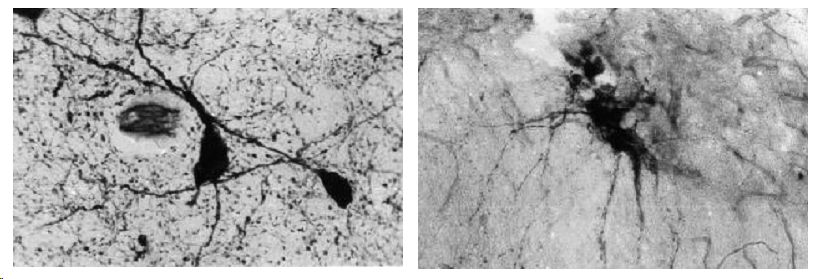
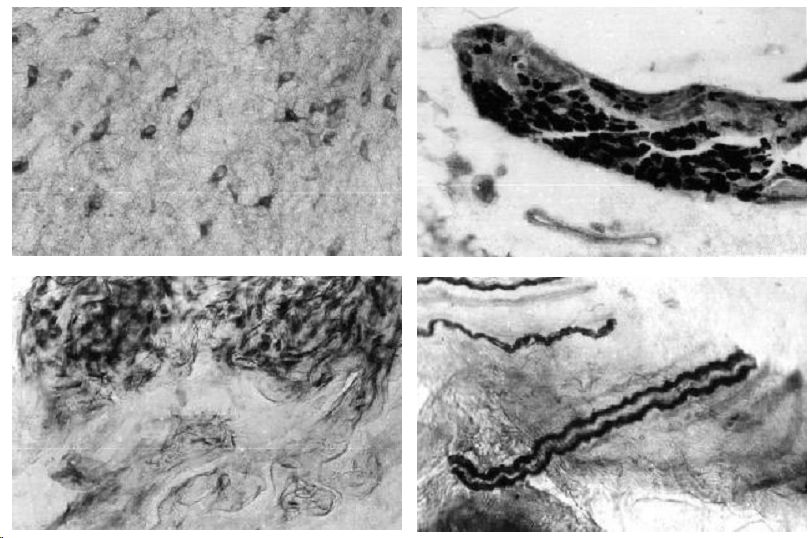
Рис 1. NADPH-диафораза центральных и периферических отделов репродуктивной системы самцов крыс. Метод Vincent, Hope.
А - нейроны с высокой активностью фермента; Б нейроны с низкой активностью фермента;
В - нейроны боковых рогов спинного мозга; Г - нейроны вегетативного микроганглия;
Д - нервные волокна НПО; Е - гладкомышечные клетки наружной части кавернозных тел.
Увеличение: а, д, е 400; б, в, г 200.
Таблица 1. Метрические параметры NADPH-реактивных структур
|
Изучаемый параметр |
Исследуемый отдел |
контроль |
эксперимент |
|||||
|
относительное количество NO-ергических нейронов (%) |
стресс |
Алкогольная интоксикация |
Интоксикация марганцем |
|||||
|
острый |
хронический |
острая |
хроническая |
острая |
хроническая |
|||
|
Гипоталамус |
25+2.24 |
27+2.24 |
30+3.45 |
30+3.16 |
52+3.12 |
31+3.17 |
63+4.50 |
|
|
Спинной мозг |
38+4.01 |
42+3.25 |
46+5.12 |
44+2.57 |
60+4.20 |
40+3.84 |
71+2.50 |
|
|
Ганглии |
72+6.17 |
78+3.05 |
84+7.87 |
74+2.15 |
83+1.14 |
76+1.55 |
86+2.12 |
|
|
относительная активность NADF-диафоразы |
Гипоталамус |
25+2.35 |
37+8.72 |
29+4.23 |
29+3.51 |
61+2.13 |
33+1.44 |
49+4.41 |
|
Спинной мозг |
31+6.10 |
45+7.50 |
33+2.2 |
37+4.91 |
49+4.47 |
36+2.32 |
44+4.55 |
|
|
Ганглии |
53+5.67 |
72+5.24 |
57+1.6 |
60+2.84 |
74+4.24 |
59+3.91 |
71+1.53 |
|
Литература
- Дюйзен И.В., Мотавкин П.А., Шорин В.В. // Бюл.эксперим.биол.и мед. - 2001. - Т.132. №9. - С.354-357.
- Келли Г. Основы современной сексологии. - СПБ: Питер. - 2000. - 896с.
- Коржевский Д.Э., Отелин В.А. // Морфология. 1996. № . - С.37-40.
- Маеда Х., Анаике Т. // Биохимия. - 1998.- Т.63. - Вып.7. - С.1007-1019.
- Марков Х.М. // Вестник РАМН. - 1996. №7. - С.73-78.
- Реутов В.П., Сорокина Е.Г., Охотина В.Е., Косицын Н.С. Циклические превращения оксида азота в организме млекопитающих. М.:Наука, 1997. - 156с.
- Шерстюк Б.В., Пиголкин Ю.И. // Судебно-медицинская экспертиза. - 1999. №2. - С.2932.
- Banan A., Fields J.Z., Decker H., Zhang Y., Keshavarzian A. // J Pharmacol.and Exp.Ther. -2000. - vol.294(3). - P.997-1008.
- Bush P.A., Aronson W.J., Buga G.M., Rajfer J., Ignarro L.J. // J Urol . - 1992. - vol.147(6). - P.1650-5
- Carrier S, Nagaraju P, Morgan DM, Baba K, Nunez L, Lue TF // J Urol. 1997. - vol.157. -P.1088-1092
- Ferrini M., Magee T. R., Vernet D., Rajfer J., González-Cadavid N. F. // Biol Reprod. 2001. - vol.64. P. 974-982
- Ferrini M, Wang C, Swerdloff RS, Sinha Hikim AP, Rajfer J, Gonzalez-Cadavid NF. // Neuroendocrinology. 2001. - vol. 74(1). - P.1-11.
- Hope V.T., Vinsent S.R. // Hisochem.Cytochem. - 1989. - vol.37. - P.653-661.
- Hung A, Vernet D, Rajavashisth T, Rodriguez JA, Rajfer J, Gonzalez-Cadavid NF // J Androl. 1995. - vol. 16. - P.469-481.
- Jason C.Y., Ling-Zhi L. // Mol.Brain Res. -1999. - vol.68(1-2). - P.22-28.
- Jun-Li C., Yin-Ming Z., Li-Cai Z., Shi-Ming D. // Acta physiol. - 2000. - vol.52(3). - P.235-238.
- Magee T., Fuentes A.M., Garban H., Rajavashisth T., Marquez D., Rodriguez J.A., Rajfer J., Gonzalez-Cadavid N.F. // Biochem Biophys Res Commun. 1996. - vol. 226(1). - P.145-151.
- Garban H., Vernet D., Freedman A., Rajfer J., Gonzalez-Cadavid N.F. // Am J Physiol. 1995. -vol. 268. - P.467.
- Rajfer J., Aronson W.J., Bush P.A., Dorey F.J., Ignarro L.J. // New England J of Medicine. 1992. - vol.328. - P.90-94.
- Xie Y., Garban H., Ng Ch., Rajfer J., GonzalezCadavid N.F. // J Urol. 1997. - vol. 157. - P.1121-1126.



