Проблемы, возникающие при лечении пациентов с политравмой, обусловили необходимость формирования концепции «травматической болезни» (ТБ) [9]. Выявлено, что травма является мощным стрессорным фактором, вызывающим в организме пострадавшего развитие адаптационно-приспособительных реакций, направленных на сохранение гомеостаза или обеспечение нового уровня гомеостатических констант, который бы позволил функционировать организму в создавшейся стрессорной ситуации [4]. Проявления эндогенной интоксикации (ЭИ) весьма длительные, определяются в течение всех периодов травматической болезни и отражают как морфологические аспекты повреждений, состояние реактивности и резистентности организма, так и качество, и объем проводимой медицинской помощи. Система лечения пациентов с политравмой, разработанная в РНЦ «ВТО» имени академика Г.А. Илизарова, включает тактические вопросы, методики остеосинтеза, дополнительные обследования, послеоперационное ведение [5, 11]. Однако влияние этого малотравматичного метода на характер течения травматической болезни, ее патоморфоз, оцениваемый по показателям эндотоксемии, остается не до конца изученным. Цель исследования – проследить динамику показателей эндотоксемии в крови у пациентов с множественными переломами различной степени тяжести в этапах травматической болезни при использовании чрескостного остеосинтеза по Г.А. Илизарову.
Материалы и методы исследования
Обследовано 57 больных (средний возраст 44,3 ± 2,7 лет) с множественными закрытыми переломами костей конечностей. Больные были разделены на 3 группы в зависимости от степени тяжести травмы по шкале ISS: 1 группа (средний возраст 48,9 ± 3,25) – от 9 до 15 баллов; 2 группа (средний возраст 38,11 ± 2,72) – от 16 до 24 баллов; 3 группа (средний возраст 39 ± 4,47) – от 25 до 44 баллов. Все больные были пролечены с использованием метода чрескостного управляемого остеосинтеза аппаратом Илизарова. В третьей группе при высокой степени тяжести повреждений оперативное лечение проводили по принципам «damage control» с использованием модульной трансформации аппарата Илизарова на втором этапе без какой-либо конверсии остеосинтеза на внутренний.
Обследование проводилось в три этапа: в течение 2–3 недель после травмы (период ранних осложнений ТБ); 2–3 месяцев после травмы (период поздних проявлений ТБ) и свыше 3 месяцев после травмы (восстановительный период ТБ) [9]. Забор венозной крови для биохимических исследований производили путем венепункции натощак.
В качестве количественных маркеров глубины и степени патологического процесса использовали такие интермедиаты перекисного окисления липидов (ПОЛ), как диеновые конъюгаты (ДК), а также один из его конечных продуктов – малоновый диальдегид (МДА). ДК определяли по разности оптической плотности в гептановой фазе между опытной и контрольной пробами при длине волны 232 нм [10], МДА – по реакции с тиобарбитуровой кислотой [10]. Концентрацию продуктов перекисного окисления рассчитывали на мг общих липидов сыворотки крови, используя стандартные наборы реактивов фирмы “Lachema” (Чехия). Исследовали зависимость плазменной пероксидации от действия ферментных антиоксидантов эритроцитов крови. Активность фермента антиоксидантной защиты (АОЗ) – супероксиддисмутазы (СОД; КФ. 1.15.1.1) в эритроцитах крови определяли модифицированным методом Nishikimi N. [3]. Анализ среднемолекулярного пула веществ низкой и средней молекулярной массы (ВНСММ) в плазме крови и эритроцитах проводили по методу М.Я. Малаховой [7]. Олигопептидную составляющую среднемолекулярного пула (ОП) определяли методом Лоури [10]. Отдельно рассчитывалось процентное содержание катаболического пула ВНСММ. Контролем служили значения биохимических показателей плазмы крови 22-х практически здоровых людей (средний возраст 41,21 ± 2,15 лет). Для оценки достоверности различий полученных результатов с контролем использовали непараметрический критерий Манна – Уитни. Достоверность различий между выборками оценивали с помощью W-критерия Вилкоксона для независимых выборок.
Результаты исследования и их обсуждение
Биохимические изменения в динамике травматической болезни определяются, прежде всего характером, тяжестью и локализацией очага повреждения, а также совокупностью вызванных травмой местных и общих патологических и адаптационных процессов. Изменения показателей системы перекисного окисления липидов и антиоксидантной защиты являются одними из критериев степени напряжения реакций адаптации. Результаты исследований продуктов свободнорадикального окисления и антиоксидантного фермента СОД у пострадавших с политравмой, в зависимости от клинического определения степени тяжести по шкале ISS, представлены в табл. 1.
Таблица 1
Показатели ПОЛ-АОЗ в сыворотке крови пациентов с множественными переломами в динамике травматической болезни (ТБ) в зависимости от тяжести травмы по шкале ISS
|
Периоды травматической болезни (ТБ) |
№ группы |
Общие липиды (ОЛ), г/л |
Диеновые коньюгаты (ДК),нмоль/мг общих липидов |
Малоновый диальдегид (МДА), нмоль/мг общих липидов |
Супероксиддис- мутаза (СОД), мкмнст⋅109эр/мин |
|
Контроль |
4,65 (3,83; 5,88) |
2,23 (0,93; 3,02) |
1,34 (0,93; 1,4) |
41,57 (36,93; 45,33) |
|
|
1 этап (период ранних осложнений ТБ) |
1 |
**3,5 (2,5; 4,3) |
***4,97 (2,87; 7,62) |
1,26 (1,01; 2,64) |
32,61 (26,85; 45,41) |
|
2 |
**3,35 (2,91; 4,73) |
**3,62 (2,68;6,98) |
*1,65 (1,17; 2,2) |
37,17 (24,33; 50,92) |
|
|
3 |
*3,88 (2,99; 6,23) |
***4,37 (2,8; 5,39) |
1,53 (1,13; 1,82) |
48,08 (25,82; 54,62) |
|
|
2 этап (период поздних проявлений ТБ) |
1 |
**3,23 (2,56; 4,5) |
***4,95 (3,30; 7,04) |
1,41 (1,12; 2,10) |
39,42 (35,17; 56,50) |
|
2 |
**3,61 (3,23; 5,27) |
**3,07 (1,83; 5,2) |
1,46 (1,04; 1,81) |
46,05 (32,77; 56,50) |
|
|
3 |
***3,08 (2,87; 4,46) |
***3,91 (3,09; 4,13) |
*2,10 (1,57; 4,11) |
63,67 (50,61; 72,47) |
|
|
3 этап (восстановительный период ТБ) |
1 |
*3,79 (3,09; 4,44) |
*4,2 (2,26; 5,18) |
**1,69 (1,08; 2,64) |
*65,38 (49,53; 69,32) |
|
2 |
**3,05 (2,54; 3,81) |
**4,22 (2,9; 6) |
*2,41 (1,45; 6,12) |
37,35 (31,93; 59,54) |
|
|
3 |
3,72 (3,7; 3,75) |
* 3,83 (3,37; 4,29) |
1,62 (1,62; 1,63) |
33,62 (27,16; 40,07) |
Примечание. В таблице представлены медианы значений и интерквартильный размах признака М (25; 75 %); группы пациентов: 1-я менее 16 баллов по ISS; 2-я 16–24 балла по ISS; 3-я более 25 баллов по ISS.; достоверные различия показателей по сравнению с контрольными значениями при уровнях значимости: *р < 0,05, **р < 0,01, ***р< 0,001.
Анализ данных показал увеличение активности процессов ПОЛ в группах сравнения. На первом этапе отмечалась неоднозначная динамика изменения конечного продукта ПОЛ – МДА у больных в зависимости от тяжести травмы. Так, рост уровня МДА на первом этапе во 2 группе был повышен не только относительно контрольных значений данного метаболита (р < 0,05), но и между группами (р < 0,01). На втором этапе ТБ уровень МДА возрос относительно контрольных значений у больных третьей группы (р < 0,05). Необходимо отметить, что в восстановительном периоде концентрация конечного продукта ПОЛ возросла во всех группах независимо от тяжести повреждения. Анализ первичных продуктов ПОЛ – диеновых конъюгатов (ДК) выявил общую тенденцию достоверного повышения пероксидации в плазме крови больных не зависимо от степени тяжести травмы на протяжении всех этапов обследования, что говорит о наличии у пациентов с политравмой системного оксидативного стресса. Возможно, его причина заключается в разной активности и составе субстрата окисления на разных этапах посттравматической реабилитации. Антиоксидантных механизмов оказывается недостаточно, что обуславливает резкое усиление процессов ПОЛ с образованием промежуточных продуктов радикальной природы. В процессе исследования динамики изменения внутриклеточного антиоксиданта супероксиддисмутазы (СОД) мы не отметили значимых изменений его активности от контрольных значений за исключением значительной степени повышения данного фермента на 57 % (р ˂ 0,05) у пациентов 1 группы (с более `легкой степенью тяжести травмы) в восстановительном периоде. Это свидетельствует о более стабильном состоянии антиоксидантной системы крови по сравнению с пациентами, имеющими повреждения, соотносимые с более высокими показаниями степени тяжести травмы по шкале ISS. Для дополнительного исследования полученных результатов динамики соотношения в системе ПОЛ–АОЗ в процессе наблюдения мы использовали интегральный индекс (ИИ), объединяющий показатели в соотношение (ДК + МДА)/СОД [6] (рисунок). В восстановительном периоде наиболее благоприятное соотношение в системе крови оксидант – антиоксидант наблюдалось у пациентов с более легкой степенью повреждения, так как значение ИИ в первой группе было наиболее приближено к контролю. Однако в период ранних осложнений и поздних проявлений ТБ уровень индекса в системе ПОЛ-АОЗ у данных пациентов был повышен. В целом показатели продуктов перекисного окисления липидов, оставались повышены на протяжении всего периода обследования независимо от тяжести травмы, в то время как активность СОД в основном не отличалась от контрольных значений.
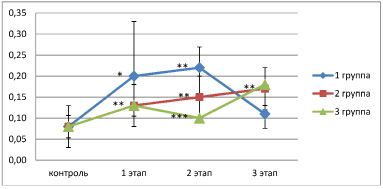
Интегральный индекс соотношения метаболитов плазмы крови в системе ПОЛ-АОЗ у пациентов с множественными переломами на периодах ТБ в зависимости от тяжести травмы по шкале ISS. Примечание. На графике представлены медианы значений и интерквартильный размах признака М (25; 75 %), группы пациентов: 1-я менее 16 баллов по ISS; 2-я 16–24 балла по ISS; 3-я более 25 баллов по ISS.; достоверные различия показателей по сравнению с контрольными значениями (с уровнем значимости *р < 0,05, **р < 0,01, ***р < 0,001)
Перекисное окисление липидов является компонентом биологической реакции воспаления [12], его инициирует появление эндогенных патогенов, в свою очередь нарушение окислительно-восстановительного баланса приводит к развитию эндотоксикоза, одного из центральных звеньев патогенеза травматической болезни [1]. Появление эндогенных субстанций, веществ низкой и средней молекулярной массы (ВНСММ) и продуктов белкового распада олигопептидов (ОП) характеризует меру метаболического ответа организма на травму. В состав ВНСММ входят конечные продукты обмена в высоких концентрациях, промежуточного и измененного метаболизма. При анализе полученных данных отмечалось достоверное увеличение содержания ВНСММ в плазме крови (табл. 2) с преобладанием веществ катаболического происхождения у больных с разной степенью травматизации в течение всех этапов наблюдения. Количество ВНСММ, определяемое в эритроцитарной массе крови, достоверно снижалось в первой и второй группах в период ранних осложнений, что, вероятно, говорит об истощении сорбционной емкости эритроцитов [2]. В период поздних проявлений и в восстановительном периоде не было обнаружено изменения содержания ВНСММ на эритроцитах крови. Олигопептидная составляющая среднемолекулярного пула плазмы в целом не превышала контрольные значения, за исключением повышения ОП во второй группе в период ранних осложнений в 1,3 раза (р ˂ 0,001) и в восстановительном периоде в третьей группе в 1,5 раза (р ˂ 0,001). Это позволяет предположить в составе средних молекул плазмы в основном повышенное содержание веществ небелкового происхождения, в том числе, продуктов пероксидации липидов.
Таблица 2
Динамика уровня молекул низкой и средней молекулярной массы у пациентов с множественными переломами в динамике травматической болезни (ТБ) в зависимости от тяжести травмы по шкале ISS
|
Периоды травматической болезни (ТБ) |
№ группы |
ВНСММ усл.ед. оптич. плотности, плазма |
ВНСММ усл.ед. оптич. плотности, эритроциты |
Катаболический пул (КП), % плазма |
Катаболический пул (КП), % эритроциты |
Олигопепт. (ОП), мкг/мл плазма |
Олигопепт. (ОП), мкг/мл эритроциты |
|
Контроль |
8,3 (7,5; 9,7) |
8,2 (6,1; 10,3) |
9,17 (7,1; 13,4) |
36,7 (35,8; 37,8) |
252,11 (242,6; 302) |
177,96 (149,3; 199) |
|
|
1 этап (период ранних осложнений ТБ) |
1 |
**11,47 (8,9; 14,5) |
***5,8 (3,59; 7,4) |
***33,31 (28,9; 36) |
38,32 (29,4; 413) |
287,07 (257,1:315) |
**131,59 (90,3; 174,9) |
|
2 |
***13.34 (10,2; 15) |
*5,58 (3,94; 8,5) |
***29,14 (22,7; 36) |
38,54 (33,3; 40,6) |
***333,75 (289,3; 357) |
***123,75 (99,33; 164) |
|
|
3 |
***12,49 (9,5; 18,1) |
9,09 (5,54; 9,3) |
***28,52 (25,7; 32) |
39,12 (38,9; 42,3) |
257,03 (251,6; 260) |
124,09 (100,9; 198) |
|
|
2этап (период поздних проявлений ТБ) |
1 |
***12,64 (10,2; 15) |
7,15 (4,26; 9,7) |
***31,13 (22,3; 35) |
37,67 (35,3; 43,4) |
271,85 (256,3; 284) |
**129,21 (97,37; 187) |
|
2 |
***13 (11,6; 14) |
6,86 (4,2; 9,4) |
***34,58 (30,1; 39) |
40,67 (36,2; 43,9) |
276,48 (252,5; 296) |
***145,91 (109,8; 159) |
|
|
3 |
12,64 (10,2; 14) |
5,97 (4,98; 8,4) |
***22,13 (20,5; 25) |
***33,97 (29,6; 34,7) |
294,73 (294,6; 295) |
177,95 (136,7; 196) |
|
|
3 этап (восстановительный период ТБ) |
1 |
***12,26 (10,9; 15) |
9,15 (8,65; 12) |
***27,69 (24,2; 32) |
36,76 (35,1:40,3) |
264,21 (254,8; 283) |
202,5 (178,6; 272) |
|
2 |
***11,26 (9,9; 14,2) |
6,51 (3,97; 8,2) |
***28,61 (17,8; 35) |
38,79 (34,7; 42,6) |
270,62 (258; 288) |
**150,35 (118; 161,6) |
|
|
3 |
***29,91 (25,2; 34) |
5,02 (4,03; 6) |
***31,08 (30,1; 32) |
***25,9 (21,7; 30,1) |
***391,58 (368,4; 414) |
***115,23 (113,5; 116) |
Примечание. В таблице представлены медианы значений и интерквартильный размах признака М (25; 75 %); группы пациентов: 1-я менее 16 баллов по ISS; 2-я 16–24 балла по ISS; 3-я более 25 баллов по ISS.; достоверные различия показателей по сравнению с контрольными значениями (с уровнем значимости*р < 0,05, **р < 0,01, ***р < 0,001).
Известно, что показатели активности продуктов перекисного окисления липидов (ПОЛ) и вещества низкой и средней молекулярной массы (МНСММ) относятся к группам критериев, характеризующих выраженность вторичной аутоагрессии, связаны с оценкой баланса компонентов гуморальных регуляторных систем [8].
Заключение
Результаты проведенного нами исследования свидетельствуют о нарушении баланса свободнорадикального окисления, что отражается в системном накоплении токсических продуктов ПОЛ в крови у всех пациентов с политравмой в течение всего посттравматического периода. Повышенное содержание ВНСММ и их состав, а также перераспределение ВНСММ и ОП между плазмой и эритроцитами крови свидетельствуют о накоплении неокисляемых продуктов распада вследствие нарушения системной регуляции и перестройки, обменных процессов организма в результате множественной травмы.
При политравме, несмотря на разный уровень реактивности и резистентности организма, у больных с множественными повреждениями различной степени тяжести, присутствуют признаки эндогенной интоксикации. Травматическая болезнь с точки зрения эндотоксемии сопровождается накоплением в крови веществ низкой и средней молекулярной массы (ВНСММ) и представляет собой дисбаланс в системе ПОЛ-АОЗ, который сохраняется в течение длительного времени после травмы. Рост показателей эндотоксемии с увеличением тяжести повреждения в восстановительный период диктует необходимость активных лечебно-профилактических мероприятий не только в ближайшие, но и отдаленные периоды травматической болезни.



