В связи с широким распространением резистентных штаммов микроорганизмов, формированием биопленок, снижением эффективности антибиотикотерапии, лечение хронического остеомиелита до сих пор остается одной из сложных и актуальных проблем гнойной хирургии [4]. Наиболее частыми возбудителями хронического остеомиелита являются грамположительные кокки рода Staphylococcus spp. с преобладанием S. aureus и грамотрицательные бактерии, в частности Pseudomonas aeruginosa, Escherichia coli и Klebsiella pneumoniae, которые, как правило, высеваются в ассоциации со стафилококком [5, 6]. Наличие у больных в очаге воспаления K. pneumoniae, P. aeruginosa чаще всего свидетельствует о присоединении внутрибольничной флоры. В развитии патологического процесса при грамотрицательной инфекции имеют значение как токсины и токсичные продукты, выделяемые бактериями, так и возбудитель вследствие его высокой способности к инвазии [2]. Более того, для очень многих грамотрицательных микроорганизмов, таких как К. pneumoniae, P. aeruginosa, и др. доказана способность формировать биопленки и вызывать хронизацию инфекционного процесса [7]. Плохое проникновение антибактериальных препаратов в биопленку может приводить к отбору устойчивых штаммов, и как следствие, к возникновению рецидивов инфекции [8, 9].
Изучение этиологической роли грамотрицательной микрофлоры при хроническом остеомиелите, их биопленкообразующей способности и антибиотикочувствительности к используемым в лечении инфекции препаратам имеет большое практическое значение для оценки эффективности проводимой антибиотикотерапии, поиска новых путей диагностики и подавления роста биопленок.
Цель исследования
Изучить антибиотикочувствительность штаммов K. pneumoniae, выделенных из ран больных хроничеcким остеомиелитом, оценить биопленкообразующую способность монокультур и их ассоциаций (K. pneumoniae + S. aureus), полученных in vitro.
Материалы и методы исследования
Исследованы 18 клинических штаммов бактерий, принадлежащих к 2 таксонам (S. aureus – 6, K. pneumoniae – 12), выделенных из свищей в дооперационном периоде и из очага воспаления во время операции у 10 пациентов с хроническим остеомиелитом длинных трубчатых костей. Изучена биопленкообразующая способность монокультур штаммов K. pneumoniae и их ассоциаций, полученных in vitro (K. pneumoniae + S. aureus – 6).
Идентификацию и определение чувствительности исследуемых штаммов к антибактериальным препаратам проводили на бактериологическом анализаторе WalkAway-40 Plus («Siemens», США). При характеристике антибиотикочувствительности микроорганизмов использовались общепринятые показатели: «чувствительные», «умеренно резистентные» и «резистентные» штаммы.
Адгезивную активность штаммов изучали на модели эритроцитов человека А (ІI) Rh+ по методике В.И. Брилиса [1]. При оценке адгезивных свойств использовали индекс адгезивности микроорганизмов (ИАМ). Исследование проводили под световым микроскопом, учитывая в общей сложности не менее 50 эритроцитов. Микроорганизмы считали неадгезивными при ИАМ – до 1,75; низкоадгезивными – от 1,76 до 2,5; среднеадгезивными – от 2,51 до 4,0; высокоадгезивными ≥ 4,1.
Исследование способности выделенных штаммов формировать биопленки на поверхности 96-луночных полистироловых планшетов проводили по методу G.OʼToole и R. Kolter [10]. По уровню адсорбции красителя этанолом, измеренному в единицах оптической плотности (OD630) на фотометре ELx808 (BioTek, США) при длине волны 630 нм оценивали активность формирования биопленки. Для интерпретации полученных данных определяли способность штаммами формировать биопленки в соответствии с критериями, разработанными Stepanovic S. et al. [11]: при значениях OD630 ниже 0,090 – считали, что штаммы не обладали способностью к образованию биопленки; при 0,090 < OD630 ≤ 0,180 – штаммы обладали слабой; при 0,180 < OD630 ≤ 0,360 – средней; при OD630 ˃ 0,360 – высокой способностью к образованию биопленки.
Статистическую обработку результатов проводили с помощью программного обеспечения анализа данных AtteStat, версия 13.0 [3]. Значимость различий между группами проверяли с помощью непараметрических критериев Вилкоксона и Манна-Уитни. Различия между группами наблюдений считались статистически значимыми при Р < 0,05.
Результаты исследования и их обсуждение
По результатам микробиологического исследования K. pneumoniae была выявлена у 4 пациентов в монокультуре, у 8 – в составе ассоциации со S. aureus. Штаммы S. aureus обладали низкоадгезивными свойствами (ИАМ – 1,85 ± 0,13 усл. ед.), штаммы K. pneumoniae – среднеадгезивными свойствами (ИАМ составил 2,94 ± 0,12 усл. ед.).
По данным фотометрического анализа, наиболее активно биопленку на поверхности 96-луночного полистиролового планшета формировали штаммы K. pneumoniae, о чем свидетельствуют средние значения оптической плотности OD630 (рис. 1). Штаммы S. aureus характеризовались низкой способностью к формированию биопленки, что согласуется с данными адгезивной способности микроорганизмов. Уже через 24 ч исследования уровень биопленкообразования штаммов K. pneumoniae в 3,2 раза был выше контрольных значений.
Через 48 ч наблюдали активный рост биопленок по сравнению с контролем, что подтверждается значениями оптической плотности. Уровень биопленкообразования штаммов S. aureus был в 1,4 раза выше по сравнению с суточными значениями монокультур. Биопленкообразующая способность штаммов K. pneumoniae в 2,8 раза была выше контрольных показателей и незначительно выше суточных значений.
Интенсивность биопленкообразования ассоциации микроорганизмов (K. pneumoniae + S. aureus) на первые сутки эксперимента была в 1,7 раза выше контрольных значений и в 1,2 раза ниже оптической плотности OD630 монокультур штаммов K. pneumoniae. Через 48 ч исследования биопленкообразующая способность ассоциации бактерий (K. pneumoniae + S. aureus) достоверно не отличалась от OD630 монокультур штаммов K. pneumoniae.
Характеристика чувствительности штаммов K. pneumoniae к антибактериальным препаратам представлена на рис. 2.
При анализе активности β-лактамных антибиотиков обращает на себя внимание высокая частота резистентности к ампициллину (90 % нечувствительных штаммов), к цефепиму (60 %). Неактивны в отношении K. pneumoniae были защищенные бета-лактамы: 90 % резистентных штаммов K. pneumoniae к амоксициллин/клавулановой кислоте.
Из группы хинолонов устойчивость к ципрфлоксацину проявили 80 % штаммов K. pneumoniae. Среди карбапенемов выявлен высокий процент чувствительных штаммов к имипенему и меропинему (100 %).
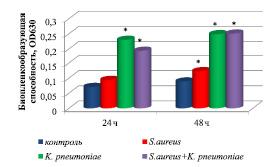
Рис. 1. Биопленкообразующая способность штаммов S. aureus, K. pneumoniae и их ассоциации (K. pneumoniae + S. aureus), полученных in vitro. Примечание. * – уровень значимости различий по сравнению с контрольными значениями (P ˂ 0,05)
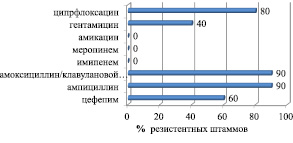
Рис. 2. Характеристика резистентных к антибиотикам штаммов Kl. pneumoniae, выделенных от больных хроническим остеомиелитом ( %)
В группе аминогликозидных препаратов эффективным в отношении штаммов K. pneumoniae был амикацин (100 % чувствительных штаммов) и гентамицин (60 %).
Штаммы К. pneumoniae характеризовались высокой частотой резистентности к используемым антибактериальным препаратам. Различий в антибиотикочувствительности между штаммами K. pneumoniae, выделенными в монокультуре и в составе ассоциации со S. aureus не наблюдалось. Наибольшей эффективностью в отношении штаммов K. pneumoniae обладали имипенем и карбапенем.
Возросшая антибиотикорезистентность и развитие биопленок являются огромной проблемой в лечении хронических инфекций. Так, например, показана неэффективность использования ампициллина и ципрофолксацина при лечении инфекций, вызванных штаммами К. pneumoniae [8].Одной из негативных характеристик биопленок является то, что они, как правило, проявляют устойчивость одновременно ко многим антибиотикам из разных групп [12]. В связи с этим возникает необходимость поиска новых подходов в лечении биопленочных инфекций.
Выводы
Штаммы К. pneumoniae обладают выраженными адгезивными свойствами. На поверхности полистироловых планшетов активно формируют биопленки. Биопленкообразующая способность ассоциации микроорганизмов (K. pneumoniae + S. aureus) через 48 ч исследования не отличается от уровня биопленкообразования монокультур штаммов K. pneumoniae.
В целом, выделенные штаммы K. pneumoniae характеризуются низким уровнем чувствительности к большинству антибактериальных препаратов.
Несмотря на низкий процент выделения штаммов K. pneumoniae из ран больных хроническим остеомиелитом, высокая способность к биопленкообразованию и возросшая резистентность к антибактериальным препаратам может быть одной из причин низкой эффективности лечения инфекции, вызванной данным возбудителем.
Полученные данные важно учитывать при лечении хронического остеомиелита, вызванного бактериями K. pneumoniae.



