Введение
Эпидемиологическая и эпизоотологическая ситуация по распространению особо опасных инфекций (ООИ) в Российской Федерации и в мире в 2014 г оценивалась как неблагополучная [3,5]. На 2015 г в некоторых регионах Российской Федерации специалисты прогнозируют сохранение напряженной эпидемиологической обстановки в отношении чумы и сибирской язвы, в связи с чем вопросы стандартизации препаратов для профилактики ООИ являются актуальными [8].
Особенность стандартизации профилактических препаратов против ООИ, которые, как правило, представляют собой живые вакцины, заключается в том, что для определения биологической активности препаратов этой группы не существует Международных стандартных образцов ВОЗ (далее МСО ВОЗ). Специфическая активность живых вакцин зависит от количества жизнеспособных клеток, которая в зависимости от препарата должна составлять 40-60% от общей концентрации микробных клеток. Для оценки общей концентрации микробных клеток используют отраслевой стандартный образец мутности бактериальных взвесей ОСО 42-28-85 (далее – ОСО мутности) [1,6,7]. В Инструкции по применению ОСО мутности пересчетные коэффициенты (общая концентрация микробных клеток, соответствующая мутности 10 МЕ) установлены для следующих микроорганизмов: кишечная палочка, коклюшный, бруцеллезный и туляремийный микробы, холерный вибрион. Для таких возбудителей ООИ, как чума и сибирская язва, конкретные значения общей концентрации микробных клеток, соответствующие мутности 10 МЕ, отсутствовали.
ОСО мутности был разработан в 60-х годах прошлого века в ГИСК им. Л.А. Тарасевича [9]. Более 30 лет технология изготовления ОСО мутности, применяемые методы контроля (фотометрический), используемое сырье (стекло марки Pyrex) – не менялись. В 2010-2013 гг проведена оптимизация технологии его производства (исключены некоторые стадии, заменено измерительное оборудование, расширен перечень пригодных марок сырья, введен дополнительный метод контроля) [4]. В связи с этим возникла необходимость подтвердить соответствие мутности бактериальных взвесей, приготовленных с использованием новых серий OСО, значениям общей концентрации микроорганизмов, приведенным в Инструкции по применению ОСО мутности.
Цель исследования – установить порядок применения ОСО мутности для чумного и сибиреязвенного микробов (споровая форма). Для достижения поставленной цели необходимо было решить следующие задачи:
1. оценить значение пересчетного коэффициента для бруцеллезного микроба, суспензия которого приготовлена в сравнении с МСО мутности ВОЗ и ОСО мутности, произведенного по усовершенствованной технологии;
2. провести исследования общей концентрации микробных клеток с использованием микробиологических методов во взвесях бактериальных культур чумного и споровой формы сибиреязвенного микробов, доведенных до 10 МЕ с применением как ОСО мутности, так и МСО мутности ВОЗ.
Материалы и методы исследования
Для исследования использовали:
- ОСО мутности 42-28-85 (сер. S-5/1, изг. 02.2014), произведенный по усовершенствованной технологии;
- вакцинные штаммы, используемые при производстве и контроле качества препаратов против ООИ: Yersinia pestis EV, Brucella abortus 19 BА (получены из Государственной коллекции патогенных микроорганизмов ФГБУ «НЦЭСМП» МЗ РФ);
- вакцина сибиреязвенная живая, лиофилизат для приготовления суспензии для подкожного введения и накожного скарификационного нанесения /в комплекте с растворителем – глицерола раствор 30%/ (сер. 253);
- МСО мутности ВОЗ: 5th International Reference Preparation of Opacity, 10 МЕ (5th IRP, 76/522).
Штамм Brucella abortus 19 BА использовали как контрольный образец, для которого известен пересчетный коэффициент (1,7 млрд. м.к./мл).
Подготовка микроорганизмов
Для получения I генерации вакцинного штамма B. abortus 19 BА в ампулы вносили по 1 мл 0,9% раствора натрия хлорида. После растворения высевали в пробирку со скошенной питательной средой (мясопептонный агар (МПА)). Посевы инкубировали при температуре (37±1)ºС в течение 72±2 ч и хранили при температуре от 2 до 8ºС в течение 3-х мес. Вакцинный штамм B. abortus 19 BА I генерации высевали бактериологической петлей на чашки Петри с МПА. Посевы инкубировали при температуре (37±1)ºС в течение 72±2 ч (II генерация). Полученную культуру использовали для исследований.
Для получения I генерации вакцинного штамма Y. pestis ЕV чумного микроба в ампулы с лиофилизированной культурой вносили по 1 мл 0,9% раствора натрия хлорида. После растворения высевали в пробирку со скошенной питательной средой (агар Хоттингера). Посевы инкубировали при температуре (27±1)ºС в течение 48±2 ч и хранили при температуре от 2 до 8ºС в течение 3-х мес. Вакцинный штамм Y. pestis ЕV I генерации высевали бактериологической петлей на чашки Петри с агаром Хоттингера. Посевы инкубировали при температуре (27±1)ºС в течение 24±2 ч (II генерация). Полученную культуру использовали для исследований.
Выросшие культуры смывали 0,9% раствором натрия хлорида. Полученные суспензии доводили до мутности 10 МЕ в соответствии с Инструкцией по применению ОСО мутности и МСО ВОЗ.
Вакцина против сибирской язвы представляет собой споровую культуру B. аnthracis, штамм СТИ-1. Подготовку взвеси для оценки концентрации спор в сибиреязвенной вакцине проводили следующим образом: вакцину ресуспендировали в соответствии с НД на препарат [7], затем доводили полученную суспензию до мутности 10 МЕ в соответствии с инструкцией по применению ОСО мутности и МСО ВОЗ (5th IRP).
Инактивацию бактериальных взвесей осуществляли в соответствии с СП 1.3.3118-13 «Безопасность работы с микроорганизмами I-II групп патогенности (опасности)». При отсутствии роста специфических микроорганизмов использовали микробные взвеси в разведении 1:100 для подсчета общей концентрации микробных клеток. Для этого из пробирки с исследуемой взвесью, мутность которой соответствует мутности 10 МЕ ОСО и МСО мутности, делали последовательные десятикратные разведения с помощью 0,9% раствора натрия хлорида.
Подсчет клеток проводили в камере Горяева с помощью микроскопа Axio Scope А1 при 400-кратном увеличении (объектив 40, окуляр 10). Использование фазово-контрастного устройства позволяло исследовать суспензии неокрашенных микробных клеток.
Подсчитывали количество клеток, находящихся в 10 больших квадратах расположенных по диагонали, по 5 в каждой сетке. Осуществляли видеофиксацию изображения каждого исследуемого квадрата с помощью встроенной видеокамеры, затем проводили подсчет клеток в сделанных снимках.
Концентрацию микроорганизмов рассчитывали по формуле:
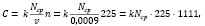
где k – разведение;
Nср = N / 10 – среднее количество клеток в одном большом квадрате;
v = 0,9 мм3 = 0,0009 мл3 – объем камеры;
n = 225 – количество больших квадратов в камере Горяева.
Статистическую обработку полученных результатов проводили с применением критерия Стьюдента.
Результаты исследования и их обсуждение
Для оценки общей концентрации микробных клеток во взвесях бруцеллезного и чумного микробов, а также спор в сибиреязвенной вакцине испытания проводили 4 оператора в условиях промежуточной прецизионности по фактору «время» (3 блока измерений).
Обобщенные результаты определения общей концентрации во взвесях бруцеллезного, чумного, сибиреязвенного микробов (споровая форма), а также их статистической оценки приведены в таблице 1.
Как следует из данных, приведенных в таблице 1, значения t-критерия Стьюдента, рассчитанные по экспериментальным данным для исследуемых взвесей всех микроорганизмов (tэксп=0,23 для B. аnthracis СТИ-1; tэксп=0,34 для Y. pestis EV; tэксп=0,54 для B. abortus 19 BА), не превышают табличное t0,95;ν = 16 =2,12.
Это значит, что различие средних значений общей концентрации микробных клеток во взвесях бруцеллезного и чумного микробов, а также в сибиреязвенной вакцине, приготовленных по ОСО (серии S-5/1) и МСО ВОЗ (5th IRP), статистически незначимо, и все полученные результаты можно использовать для установления значения соответствующих пересчетных коэффициентов.
Для B. аbortus получено значение коэффициента, равное 1,75±0,18 млрд. м.к./мл, которое практически совпадает с коэффициентом, указанным в инструкции по применению – 1,7 млрд. м.к./мл. Различие между значениями статистически не значимы, что подтверждает соответствие мутности ОСО и МСО ВОЗ (5th IRP). Таким образом, ОСО мутности, произведенный по усовершенствованной нами технологии, обеспечивает стандартизацию бактериальных взвесей визуальным методом в соответствии с Инструкцией по применению ОСО мутности.
Далее было рассчитано итоговое значение пересчетного коэффициента для Y. pestis, как среднее арифметическое значения, полученного нами (0,91±0,12 млрд. м.к./кл) и значения, приведенного в НД на вакцину чумную – 1∙109 м.к./мл [1]. Итоговое значение составило – 0,95±0,24 млрд. м.к./кл (табл. 2), что незначительно отличается от значения общей концентрации для кишечной палочки (0,93 млрд. м.к./мл), приведенной в Инструкции по применению на ОСО мутности. Это согласуется с тем фактом, что размеры чумного микроба (0,5-0,8*1,0-3,0 мкм) близки к размерам кишечной палочки (0,5-0,8*1,5-3,0 мкм) [10].
Для сибиреязвенной вакцины (споровая формы B. аnthracis) итоговое значение пересчетного коэффициента рассчитали как среднее арифметическое значения, полученного нами (0,12±0,03 млрд. м.к./кл) и значения концентрации, приведенного в МУ 3.3.2.2124-06 – 0,1∙109 спор/мл [2]. Значение пересчетного коэффициента составило – 0,11±0,06 млрд. м.к./мл (табл. 2).
Таблица 1
Результаты определения общей концентрации микробных клеток во взвесях бруцеллезного, чумного, сибиреязвенного микробов (споровая форма), приготовленных с использованием новых серий ОСО мутности и МСО ВОЗ (5th IRP)
|
Факторы промежуточной прецизионности |
Общая концентрация С, млрд. м.к./мл |
Значения t-критерия Стьюдента (P ≤ 0,95, ν = 16) |
||||
|
используемые стандартные образцы мутности |
число операторов |
Сср ± S, n = 3 |
Сср ± S, n = 18 |
CV, % |
tэксп |
tтабл |
|
B. аbortus 19 BА |
||||||
|
ОСО |
4 |
1,76±0,18 |
1,75±0,18 |
12 |
0,23 |
2,12 |
|
МСО |
2 |
1,74±0,17 |
||||
|
Y. pestis EV |
||||||
|
ОСО |
4 |
0,92±0,13 |
0,91±0,12 |
13 |
0,34 |
2,12 |
|
МСО |
2 |
0,90±0,11 |
||||
|
B. anthracis СТИ-1 (споровая форма) |
||||||
|
ОСО |
4 |
0,12±0,03 |
0,12±0,03 |
25 |
0,54 |
2,12 |
|
МСО |
2 |
0,11±0,04 |
||||
Таблица 2
Значение общей концентрации микроорганизмов, соответствующей 10 МЕ по ОСО мутности
|
Микроорганизм |
Значение общей концентрации, млрд. м.к./мл |
||
|
по Инструкции применения ОСО мутности |
Сэксп ± 2S |
Диапазон Сэксп |
|
|
B. abortus |
1,7 |
1,75±0,36 |
1,39-2,11 |
|
B. anthracis (споровая форма) |
сведения отсутствуют |
0,11±0,06 |
0,05-0,17 |
|
Y. pestis |
сведения отсутствуют |
0,95±0,24 |
0,71-1,19 |
|
Примечание: Сэксп – значение концентрации по результатам подсчета в камере Горяева. |
|||
При производстве и контроле сибиреязвенной вакцины, в отличие от чумной и бруцеллезной вакцин, оценку общей концентрации проводят микроскопическим методом с использованием камеры Горяева [7]. Ошибка этого метода достигает 30%, а сама процедура достаточно трудоемка и длительна. Полученные в настоящей работе результаты позволяют сделать заключение о целесообразности исследования возможности использования пересчетного коэффициента для определения общей концентрации спор по ОСО мутности в сибиреязвенной вакцине (аналогично методике определения общей концентрации микробных клеток для чумной и бруцеллезной вакцин).
Необходимо отметить, что количество микробных клеток во взвеси зависит от их фазы роста, так как в процессе жизненного цикла меняется размер, форма и показатель преломления микроорганизма, что влияет на мутность исследуемой взвеси и значение концентрации [9]. В связи с этим значения пересчетных коэффициентов в Инструкции по применению ОСО мутности являются ориентировочными. При изменении условий культивирования при выпуске препаратов из различных штаммов может потребоваться уточнение значения коэффициента пересчета. При условии установления допустимого диапазона для коэффициента пересчета, данная величина может служить критерием стандартности культивирования микроорганизмов для каждого конкретного препарата.
Выводы
1. Экспериментально установленное значение общей концентраций клеток бруцеллезного микроба в бактериальной взвеси, приготовленной с использованием МСО ВОЗ и ОСО мутности, изготовленного по оптимизированной технологии, соответствует значению, приведенному в инструкции на ОСО мутности.
2. Разработан порядок применения ОСО мутности для оценки мутности бактериальных взвесей чумного микроба и спор вакцинного штамма сибиреязвенного микроба при определении общей концентрации микробных клеток. В дополнение к микроорганизмам, перечисленным в Инструкции по применению ОСО мутности, определены значения общей концентрации для сибиреязвенного (споровая форма) и чумного микробов.



