В настоящее время ведутся активные исследования в области синтеза соединений, которые могут найти применение в качестве мономеров для супрамолекулярных циклодекстриновых структур. Важным фактором комплексообразования является соотношение размеров полости β-циклодекстрина и молекулы «гостя».
Адамантильная группа представляет собой сферическую группу с диаметром 7 Å, который идеально соответствует полости β-циклодекстрина. В этой связи диадамантилсодержащие соединения общей формулы: Ad-X-R-X-Ad, в которых адамантильные группы разделены спейсером, являются наилучшими мономерами для создания подобных супрамолекулярных полимерных комплексов включения типа «гость - хозяин» [3, 5].
Ранее нами были получены симмеричные диадамантилсодержащие мочевины [3, 5] и тиомочевины [2, 3, 6, 8], с адамантильным радикалом в узловом [3, 7], или мостиковом положении [3, 5] и спейсерами R различной природы: алкиленовыми, ариленовыми и др. Стоит отметить, что диадамантилсодержащие димочевины, имеющие в своём составе адамантильные фрагменты, являются биологически активными соединениями в качестве ингибиторов растворимой эпоксигидролазы человека [4, 9].
Природа группы Х, связывающей адамантильную группу со спейсером, также во многом определяет прочность связывания адамантильной группы в полости фермента. В данной работе впервые в качестве такой группы Х была использована тиокарбаматная группа.
Помимо диадамантилсодержащих бис-тиокарбаматов нами были синтезированы некоторые адамантилсодержащие дитиокарбаматы, также представляющие значительный интерес в качестве биологически активных веществ с потенциальной противовирусной активностью. Ранее предлагаемые способы их получения основаны на реакциях гидрокси-, нитро-, нитрокси- и ацетоксипроизводных адамантана в сильно кислой среде с N,N-алкилдитиокарбаматами щелочных металлов [8]. Использование в синтезе концентрированной серной кислоты можно отнести к недостаткам метода.
Экспериментальная часть
Спектры ЯМР 1Н получены на ЯМР-спектрометре «BrukerDRX500» с рабочей частотой 500 МГц с использованием ДМСО-d6 в качестве растворителя. Химические сдвиги в спектрах ЯМР 1Н приведены в шкале δ относительно Me4Si как внутреннего стандарта. Масс-спектры регистрировали на хромато-масс-спектрометре «AgilentGC 5975/MSD 7820». Капиллярная кварцевая колонка HP-5MS длиной 30 м, газ-носитель – гелий.
Исходный 1-адамантилмеркаптан получали по методу [1]. Исходные 1,6-гексаметилендиизоцианат и 1,4-фенилендиизоцианат производства фирмы «Aldrich» использовали без очистки. Тетраметилтиурамдисульфид и тетраэтилтиурамдисульфид по методу [10]. Диэтиловый эфир и 1,4-диоксан обезвоживали общедоступными способами. Бензол, гексан и триэтиламин перегоняли.
S,S’-(адамантан-1-ил) гексан-1,4-диил-бис(тиокарбамат) (I)
К раствору 2,05 г (0,012 моль) 1-адамантилмеркаптана в 50 мл безводного диэтилового эфира добавляли 1,01 г (0,0059 моль) гексаметилендиизоцианата и 0,3 г (0,003 моль) триэтиламина. Реакционную массу нагревали в течение 3 часов при температуре кипения растворителя. Затем диэтиловый эфир практически полностью отгоняли, осадок перекристаллизовывали из бензола, затем сушили под вакуумом. Выход (I) 2,12 г, 70 %. Твердое вещество белого цвета. Тпл = 180–181 °С. Вычислено: С28Н44N2О2S2, %: С 66,62; Н 8,79. Найдено, %: С 66,01; Н 8,39. Спектр ЯМР1Н (DMSO-D6) δ, м.д.: 7,81 с (2Н, 2NH); 2,97 д (4H, 2CH2); 2,05 с, 1,65 с (12HAd, 6СН2Ad); 1,97 с (6H, 6CHAd); 1,19 с, 1,35 с (8H, 4CH2).
S,S’-(адамантан-1-ил) фенилен-1,4-диил-бис(тиокарбамат) (II)
К раствору 1,25 г (0,0074 моль) 1-адамантилмеркаптана в 50 мл безводного 1,4-диоксана добавляли 0,58 г (0,0036 моль) 1,4-фенилендиизоцианата и 0,145 г (0,0015 моль) триэтиламина. Реакционную массу нагревали в течение 3 часов при температуре кипения растворителя. После охлаждения реакционной массы образовавшийся осадок отфильтровали, промывали 20 мл гексана и сушили под вакуумом. Выход (II) 1,62 г, 90 %. Твердое вещество белого цвета, разлагается при температуре > 295 °С. Вычислено: С28Н36N2О2S2, %: С 67,7; Н 7,3. Найдено, %: С 67,01; Н 7,29. Спектр ЯМР1Н (DMSO-D6) δ, м.д.: 8,54 с (2Н, 2NH); 7,36 с (4H, 4CH); 2,1 с, 1,65 с (12HAd, 6CH2Ad); 2,00 с (6H, 6HAd).
Адамант-1-илдиметилдитиокарбамат (Va)
В раствор 3,1 г (0,013 моль) тетраметилтиурамдисульфида (IV a) в 70 мл бензола добавляли 0,1 г кристаллического гироксида натрия. Затем в атмосфере сухого азота при комнатной температуре дозировали раствор 1,59 г (0,012 моль) свежевозогнанного ДГА (III) (соотношение тетраметилтиурамдисульфид: ДГА = 1,1:1) в 50 мл осушенного бензола. Реакционную смесь кипятили при 80 °С в течение 1 часа, бензол удаляли перегонкой при пониженном давлении, остаток промывали водой и высушивали. Продукты реакции разделяли колоночной хроматографией. Выход (Va) 2,14 г (60 %). Внешний вид белые кристаллы, температура плавления 89–90 °С, растворимы в этиловом спирте, мало растворимы в бензоле, ДМСО нерастворим в воде, ТГФ. Вычислено: С13Н21NS2, %: С 61,12; Н 8,29. Найдено, %: С 60,01; Н 8,27. Масс-спектр (ЭУ, 70 эВ) m/z, (I, %): 255 (11 %) [M]+, 167 (1 %) [M – N(C2H5)2С(S)]+, 135 (100 %) [C10H15]+, 87 (26 %) [N(C2H5)C(S)]+. Спектр ЯМР1Н (DMSO-D6) δ, м.д.: 1,71 т (3CH2Ad); 2,01 т (3HAd); 2,39 д (3CH2Ad), 3,04 с (2 N–CH3). Выход адамант-1,3-диил-бис(диметилдитиокарбамата) (VIa) 0,28 г (8 %). Внешний вид: белые кристаллы, температура плавления 260 °С, ограниченно растворим в бензоле и ДМСО, нерастворим в ДЭЭ, воде, ТГФ. Вычислено: С16Н26N2S4, %: С 51,29; Н 6,99. Найдено, %: С 52,01; Н 7,02. Спектр ЯМР 1Н, δ, м.д.: 1,14–2,4 (14Н, 1,3-Ad); 3.1 (12Н, СН3). Масс-спектр (ЭУ, 70 эВ) m/z, (I, %): 374 (0 %) [M]+, 289 (28 %) [M – N2(CH3)4]+, 169 (100 %) [M – SN2(CH3)4]+, 133 (64 %) [C10H13]+, 88 (96 %) [N(CH3)2C(S)]+.
Адамант-1-илдиэтилдитиокарбамат (Vb)
(Vb) получают аналогично (Vа) из 3,5 г (0,012 моль) тетраэтилтиурамдисульфида (IV b) и 1,46 г (0,011 моль) свежевозогнанного ДГА. Выход (Vb) 2,43 г (78 %). Внешний вид белые кристаллы, температура плавления 93–95 °С, растворимы в этиловом спирте, мало растворимы в бензоле, ДМСО нерастворим в воде, ТГФ. Вычислено: С15Н25NS2, %: С 63,55; Н 8,89. Найдено, %: С 61,75; Н 8,19. Масс-спектр (ЭУ, 70 эВ) m/z, (I, %): 283 (18 %) [M]+, 167 (1 %) [M – N(C2H5)2С(S)]+, 135 (100 %) [C10H15]+, 116 (10 %) [N(C2H5)2С(S)]+. Спектр ЯМР1Н (DMSO-D6) δ, м.д. 1,71 т (3CH2Ad); 2,01 т (3HAd); 2,39 д (3CH2Ad), 3,87 к (2N–CH2)б, 1,15 т (2СН3). Выход адамант-1,3-диил-бис(диэтилдитиокарбамата) (VIb) 0,13 г (4 %). Внешний вид белые кристаллы, температура плавления 89–90 °С, растворимы в этиловом спирте, мало растворимы в бензоле, ДМСО нерастворим в воде, ТГФ. Вычислено: С20Н34N2S4, %: С 55,77; Н 7,69. Найдено, %: С 56,01; Н 7,49. Масс-спектр (ЭУ, 70 эВ) m/z, (I, %): 255 (11 %) [M]+, 167 (1 %) [M – N(C2H5)2С(S)]+, 135 (100 %) [C10H15]+, 87 (26 %) [N(C2H5)C(S)]+. Спектр ЯМР 1Н, δ, м.д.: 1,14–2,4 (14Н, 1,3-Ad); 3,87 к (8Н, СН2), 1,15 т (12Н, СН3).
Результаты исследования и их обсуждение
Образование (S, S’)-диадамантиловых бис-тиокарбаматов основано на реакции 1-адамантилмеркаптана с диизоцианатами (гексаметилендиизоцианатом и 1,4-фенилендиизоцианатом) в присутствии триэтиламина при мольном соотношении 1-адамантилмеркаптан : диизоцианат : триэтиламин, равном 2:1:0,4 (рис. 1).
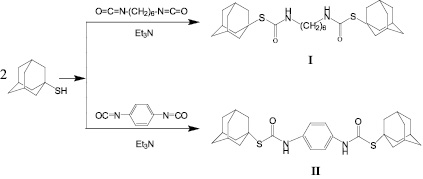
Рис. 1
Синтез симметричных диадамантилзамещённых бис-тиокарбаматов проводили в среде безводного растворителя (для (I) диэтиловый эфир, для (II) 1,4-диоксан) в течение 3 часов при температуре кипения растворителя. Выбор 1,4-диоксана для синтеза (II) обусловлен лучшей растворимостью в нем исходного 1,4-фенилендиизоцианата.
Соединение (I) выделяли отгонкой растворителя с последующей перекристаллизацией из бензола. Выход продукта составил 70 %.
Соединение (II) плохо растворимо в 1,4-диоксане и в ходе реакции выпадает в осадок, который после завершения синтеза отфильтровывали и промывали гексаном. Выход продукта составил 90 %.
Следует отметить, что при анализе продуктов реакции методом хромато-масс-спектрометрии на выходе из колонки детектировались два пика, один из которых соответствовал исходному диизоцианату, а другой – 1-адамантилмеркаптану. Это, вероятно, связано с тем, что синтезированные S,S’-(адамантан-1-ил) R-1,4-диил-бис(тиокарбаматы) разлагаются в испарителе хромато-масс-спектрометра. Отсутствие на хроматограмме пиков других соединений является подтверждением протекания реакции с практически 100 %-ной селективностью.
Адамантилсодержащие дитиокарбаматы были синтезированы взаимодействием ДГА и соответствующих тетраалкилтиурамдисульфидов (тетраметилтиурамдисульфида и тетраэтилтилтиурамдисульфида) в присутствии кристаллического гидроксида натрия при соотношении тетраалкилтиурамдисульфид: ДГА = 1,1:1 (рис. 2).
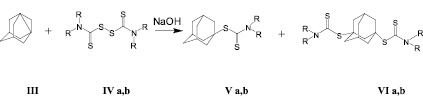
где R = Me (a); Et (b)
Рис. 2
Реакцию проводили в среде безводного бензола при температуре кипения растворителя в течение 1 часа. Анализ реакционной массы показал, что при взаимодействии ДГА (III) и тетраалкилтиурамдисульфида в присутствии гидроксида натрия в основном образуется адамант-1-илдиалкилдитиокарбамат и некоторое количество адамант-1,3-диилбис(ди-R-дитиокарбамата), являющегося продуктом внедрения адамантильного радикала по дисульфидной связи. Свойство ДГА расщеплять различные дисульфиды по связи S-S с образованием продуктов 1,3-присоединения с практически 100 %-ной селективностью было изучено нами ранее в работе [6]. Проведение реакции с тетраалкилтиурамдисульфидами в присутствии кристаллической щелочи преимущественно направляет процесс в сторону образования продукта моноприсоединения к адамантильному радикалу в узловом положении.
Было установлено, что соотношение продуктов реакции зависит от заместителя R в исходном тетраалкилтиурамдисульфиде. Так, при взаимодействии ДГА с (IV a) выход продуктов (Va) и (VI a) составляет 89 и 11 % соответственно. В реакции ДГА с (IV b) соединения (Vb) и (VI b) образуются с выходом 93 и 7 %.
Следует отметить, что описанный способ в сравнении с существующими позволяет получать адамант-1-илдиалкилдитиокарбаматы с высоким выходом в мягких условиях, не используя концентрированные кислоты.
Для подтверждения структуры полученных соединений использовали ЯМР1Н-спектроскопию, а также хромато-масс-спектрометрию.
Выводы
Синтезированы ранее неизвестные симметричные S,S’-диадамантилсодержащие бис-тиокарбаматы, которые могут быть использованы в качестве мономеров для циклодекстриновых супрамолекулярных полимеров. Образование данных соединений протекает в мягких условиях с высокой селективностью.
Реакцией ДГА и тетраалкилтиурамдисульфидов в присутствии гидроксида натрия синтезированы адамант-1-илдиалкилдитиокарбаматы с высоким выходом в мягких условиях.
Работа выполнена при финансовой поддержке РФФИ (Грант № 12-03-33044).



