Жидкофазное гидрирование используется в промышленности для гидрирования целого ряда ароматических нитросоединений. В работе [10] рассмотрены современные тенденции развития методов конструирования катализаторов. Отмечено, что современный период характеризуется переходом от чисто гомогенных или гетерогенных каталитических контактов к использованию мультифазных гомогенных, гетерогенизированных гомогенных, гомогенизированных гетерогенных каталитических систем. Наиболее распространенным методом получения ароматических аминов является каталитическое гидрирование ароматических нитросоединений. Недостатком существующих процессов гидрирования являются высокие давления и температуры, невысокая селективность реакций. В этой связи в настоящее время активно ведутся исследования в области создания новых каталитических систем [11, 8]. Особую роль в этом играют катализаторы платиновой группы, нанесенные на различные носители [1].
На современном этапе развития промышленности возрастает значение редкоземельных элементов (РЗЭ). В химической промышленности РЗЭ применяют в производстве пигментов, лаков, красок; в нефтехимической и нефтеперерабатывающей промышленности – в качестве катализаторов. Катализаторная подотрасль потребляет около 25 % от всех получаемых РЗЭ [2]. При этом они входят в состав катализатора, как в качестве активной фазы, а также в виде носителей [14, 15].
Работа является продолжением проводимых на кафедре исследований активности катализаторов на основе платиноидов, содержащих оксиды редкоземельных элементов (РЗЭ) в реакции гидрирования ароматических нитросоединений: нитробензола [3,4], о-нитроанизола [5], бензальдегида [6], n-хлорнитробензола [13], n-нитрофенола [7, 12].
Результаты исследования и их обсуждение
В работе исследовалась кинетика гидрирования нитробензола на платиновых катализаторах, содержащих оксиды РЗЭ (1 %Pt/Eu2O3, 1 %Pt/Sm2O3), расположенные практически в центре лантанидного ряда потенциометрическим методом. Методика приготовления катализаторов представлена в работе [9]. Условия гидрирования: температура 20 ± 5 °С, давление водорода 101325 Па, объем нитробензола 0,2 мл, навеска катализатора – 0,2 г, реакционная среда – вода. Схема установки представлена на рис. 1.
Водород из генератора водорода (1) через редуктор (2) и ряд очистительных склянок (3, 4, 5) подавался в газометр (6), из которого через систему трехходовых кранов (7) водородом заполняли измерительные газовые бюретки (8), соединенные с сосудом (9) для того, чтобы измерение объема водорода производилось при атмосферном давлении.
Реакционным сосудом служила каталитическая «утка» (10), закрепленная на качалке (11), которая приводилась в действие электромотором (12). «Утка» снабжена устройством для ввода гидрируемого вещества, подвода и отвода водорода и термостатированной рубашкой, соединенной с термостатом (13). Рабочий объем «утки» составлял 180–200 мл. Во время опытов поддерживалась постоянная температура. «Утка» имеет систему электродов, позволяющих определять электродный потенциал системы «газ – гидрируемое вещество – катализатор». Электродом сравнения служит каломельный электрод, индикаторным – водородный. Потенциал системы измеряли с помощью потенциометра «рН – 340» (14).
Интенсивность перемешивания составляет 500–550 качаний в минуту при амплитуде колебания 8–10 см, что, по предварительно проведенным опытам, обеспечивает протекание реакции каталитического гидрирования ароматических нитросоединений в кинетической области, т.е. при отсутствии внешнедиффузионного торможения.
Известно, что гидрирование нитробензола может сопровождаться образованием промежуточных соединений, процессами конденсации, а также гидрированием ароматического кольца. Анализ продуктов реакции гидрирования нитробензола на 1 % Pt катализаторах, содержащих оксиды Eu2O3, Sm2O3 и Al2O3 в качестве носителей, методом газо-жидкостной хроматографии показал наличие только одного продукта – анилина, что свидетельствует о высокой селективности гидрирования.
На рис. 2 представлены типичные кривые гидрирования нитробензола на 1 %Pt/Eu2O3, 1 %Pt/Sm2O3 и 1 %Pt/Al2O3 катализаторах. Вверх, по оси ординат, отложена скорость гидрирования нитробензола (W), выраженная в мл поглощенного водорода в минуту, а вниз, – потенциал (Е), который говорит о насыщении катализатора водородом.
По оси абсцисс отложен объем (V) поглощенного в ходе реакции водорода. Поглощенный объем водорода (130 мл) соответствует теоретическому, т.е. можно сказать, что реакция гидрирования нитробензола протекает количественно. Прямолинейный участок на кривых 1,2,3 свидетельствует о постоянной скорости гидрирования до достижения ≈ 80 % конверсии нитробензола. При этом скорость гидрирования нитробензола на катализаторах, содержащих в своем составе оксиды редкоземельных элементов, в 3,7–3,4 раза выше, чем на 1 %Pt/Al2O3. После 80 % конверсии нитробензола наблюдается замедление реакции вплоть до полного превращения нитробензола в анилин.
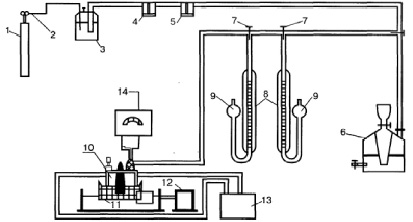
Рис. 1. Схема установки для каталитического гидрирования ароматических нитросоединений: 1 – генератор водорода; 2, 7 – кран; 3, 4, 5 – очистительные склянки; 6 – газометр; 8 – измерительные бюретки; 9 – груша; 10 – каталитическая «утка»; 11 – качалка; 12 – электромотор; 13 – термостат; 14 – потенциометр
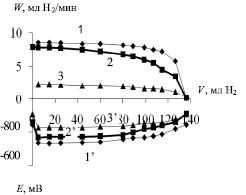
Рис. 2. Кинетические и потенциометрические кривые гидрирования нитробензола на 1%Pt/Eu2O3 (1), 1%Pt/Sm2O3 (2) и 1%Pt/Al2O3 (3) катализаторах
Полученные результаты скорости гидрирования нитробензола подтверждаются потенциалом насыщения катализатора водородом. Большее смещение потенциала в случае 1 %Pt/Eu2O3 (кривая 1′) и 1 %Рt/Sm2O3 (кривая 2′) показывает об их повышенную каталитическую активность по сравнению с 1 %Pt/Al2O3 (кривая 3′).
На рис. 3 представлена зависимость степени превращения от времени реакции гидрирования нитробензола Х = f(τ). Из рисунка видно, что представленная зависимость носит прямолинейный характер до ~ 80 % превращения. Время полного гидрирования для представленных катализаторов различно. Так, на наиболее активном 1 %Pt/Eu2O3 катализаторе реакция заканчивается за 30 минут, на 1 %Pt/Sm2O3 – 35 минут, а на катализаторе, содержащем Al2O3, за 70 минут.
На основании полученных данных методом подстановки были рассчитаны константы скорости реакции по уравнениям нулевого, первого и второго порядка по нитробензолу и определен порядок реакции.
Расчеты показали, что порядок реакции псевдопервый по нитробензолу. Значения констант скоростей представлены в таблице.
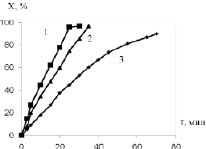
Рис. 3. Зависимость степени превращения нитробензола от времени на 1% платиновых катализаторах, содержащих: 1 – Eu2O3; 2 – Sm2O3; 3 – Al2O3
Расчетные значения константы скорости реакции гидрирования нитробензола
|
Катализаторы |
1 % Pt/Eu2O3 |
1 % Рt/Sm2O3 |
1 % Pt/Al2O3 |
|
k, (мин·г Kt)–1 |
0,3750 |
0,3450 |
0,1050 |
Полученные кинетические данные были обработаны методом наименьших квадратов. Величины единичных отклонений и выборочной дисперсии среднего результата не выходили за пределы ошибок.
Выводы
1. Платиновые катализаторы: 1 %Pt/Eu2O3, 1 %Pt/Sm2O3, содержащие в своем составе оксиды редкоземельных элементов, обладают повышенной в 3,7–3,4 раза активностью по сравнению с катализатором сравнения – 1 %Pt/Al2O3.
2. Скорость реакции гидрирования имеет псевдопервый порядок по нитробензолу.
3. Гидрирование нитробензола происходит в мягких условиях (комнатная температура, атмосферное давление) с временем полного гидрирования 30–35 мин.



