Биметаллический нитрид Ni2Mo3N является перспективным катализатором для ряда химических процессов. Он способен заменить благородные металлы в каталитических реакциях разрыва ароматических колец в дизельном топливе [7]. При этом октановое число топлива повышается на 1–4 единицы.
Ni2Mo3N может быть использован для замены катализаторов на основе рения и осмия в реакции синтеза аммиака [6].
Нитрид Ni2Mo3N рассматривался в качестве кандидата для замены платиновых катализаторов в электрокаталитической реакции получения водорода путем расщепления воды [5]. По своей каталитической активности и продолжительности действия он приближается к платиновым катализаторам.
Показана достаточная эффективность [1] двойного никель-молибденового нитрида в качестве катализатора в реакции получения метана из углекислого газа и водорода.
Методы получения двойного нитрида Ni2Mo3N, указанные в работах [5–7], характеризуются использованием небезопасного газа аммиака, большой продолжительностью и существенными энергозатратами на нагрев. Так, в работе [7] соли-прекурсоры Ni(NO3)2·6H2O и (NH4)6Mo7O24·4H2O растворяли в NH3·H2O, затем раствор высушивали и прокаливали при температуре 773 К в течение 5 часов на воздухе. Далее нагревали в токе аммиака со скоростью 6 К/мин до 623 К и со скоростью 1 К/мин до 923 К. При этой температуре выдерживали 2 часа. После отжига охлаждали до 373 К и выдерживали при этой температуре в потоке смеси газов O2 и N2 (1 % об. O2) в течение 12 часов. Авторы [5] биметаллический нитрид получали следующим образом. Ni(NO3)2 смешивали с ((NH4)6Mo7O24, смесь высушивали и прокаливали при 400 °С в течение 2 часов. Полученный материал нагревали со скоростью 0,1 °С/мин до 600 °С в потоке смеси газов 4,5 % NH3 + смесь H2 и N2 при соотношении водорода к азоту 3/1. Затем охлаждали до комнатной температуры.
В [1] описан способ получения нитридов Ti и Zr при горении смесей оксидов этих металлов с кальцием в атмосфере азота. Этот способ (самораспространяющийся высокотемпературный синтез – СВС) характеризуется низкими удельными затратами электроэнергии, поскольку температура, необходимая для проведения синтеза, обеспечивается внутренними химическими источниками высокоэкзотермических исходных составов. Кроме того, способ достаточно прост в аппаратурном оформлении. Поэтому представляло интерес изучение возможности получения двойного никель-молибденового нитрида методом СВС. Работы по получению нитрида Ni2Mo3N в режиме горения отсутствуют.
Цель исследования – изучение возможности получения двойного никель-молибденового нитрида методом СВС.
Материалы и методы исследования
В качестве исходных материалов использовались порошки оксида никеля NiO марки «ч» ТУ 6-09-4125-80, оксида молибдена MoO3 марки «ч» ТУ 6-09-4471-77, порошок молибдена ТУ 48-19-10,5-73, порошок кальция гранулированного с диаметром гранул 0,5–2 мм производства ОАО «Чепецкий механический завод», газообразный азот повышенной чистоты ГОСТ 9293-74. Порошки оксидов смешивали в фарфоровой ступке с гранулами кальция. Смеси засыпали в бумажные цилиндрические стаканчики диаметром 20–30 мм. Термопару вводили через боковую поверхность на высоте 15–20 мм от нижнего края образца. Спай термопары находился на вертикальной оси образца. Горение осуществляли в установке постоянного объема при давлении азота 5 МПа. Горение инициировали спиралью из молибденовой проволоки диаметром 0,5 мм, которая разогревалась кратковременной подачей электрического тока. Температуру измеряли вольфрам-рениевыми термопарами ВР5/ВР20, диаметром 200 мкм. Сигнал термо-ЭДС преобразовывался в цифровой вид прибором АЦП ЛА20-USB и записывался на компьютер. Продукты горения обрабатывали в 9 %-ном растворе соляной кислоты для растворения и удаления соединений кальция. Нерастворимый остаток анализировали на содержание азота методом Кьельдаля и на анализаторе LECO ONH 836 (ТОМ ЦКП СО РАН), рентгенофазовый анализ проводили с помощью дифрактометров ДРОН 2,0 и D8 DISCOVER фирмы BRUKER. Содержание фаз в продуктах определяли количественным рентгенофазовым анализом с использованием программы DIFFRAC.EVA (BRUKER) по корундовым числам.
Результаты исследования и их обсуждение
Состав 11Ca + 2NiO + 3MoO3, соответствующий предполагаемой брутто-реакции
11Ca + 2NiO + 3MoO3 = 11CaO + Ni2Mo3N,
реагирует в азоте с выделением большого количества тепла. При этом продукты СВС формируются в виде двух слоев: оксидно-нитридный (фазы CaO и Ca3N2) с меньшей плотностью образует верхний слой, а «металлический» сплав (фазы NiMo и Mo) с бóльшей плотностью образует нижний слой. После обработки продуктов СВС в растворе соляной кислоты шлаковая часть переходит в раствор, а металлическая остается в виде слитка. По результатам химического анализа содержание азота в нем мало и составляет менее 0,2 %. Низкое содержание азота в продуктах горения связано, вероятно, с термической неустойчивостью нитридов молибдена (MoN, Mo2N), никеля (Ni3N) [4] и невозможностью их образования в условиях высоких температур синтеза.
С целью уменьшения температуры горения и текучести восстанавливаемого металла вместо кальция использовали для восстановления оксидов продукт азотирования кальция, состоящий в основном из нитрида кальция Ca3N2. Нитрид кальция синтезировали сжиганием порошка кальция в атмосфере азота по методике, описанной в [2].
Состав шихты выбирали из предполагаемой брутто-реакции
2NiO + 3MoO3 + (11/3)n·Ca3N2 = = Ni2Mo3N + 11n·CaO + ((11/3)n–1)·N2.
Значение «n» варьировали в интервале 1,2–2,75. Наибольшее значение «n» определялось пределом горения. (При n > 2,75 смеси не горели). Продукт получался в виде непрочного спеченного пористого материала без крупных расплавленных участков.
На термограммах горения (рис. 1) наблюдается перегиб в начале зоны реакции вблизи температуры 1200 °С, что близко к температуре плавления Ca3N2 (1195 °С [3]). Это служит указанием на то, что химическому взаимодействию предшествует плавление нитрида кальция.
Максимальная температура горения уменьшается с увеличением избытка кальцийсодержащего компонента (рис. 2). При этом увеличивается содержание азота в продукте (рис. 3). Уменьшение температуры обусловлено тем, что избыточный нитрид кальция при горении смесей в атмосфере азота является инертом. Биметаллический нитрид Ni2Mo3N, видимо, является неустойчивым при температурах горения и образуется на стадии остывания образца, в результате азотирования восстановленного металла. Разбавление инертным материалом и снижение температуры должны способствовать уменьшению размеров образующихся частиц металла, что способствует увеличению усвоения азота.
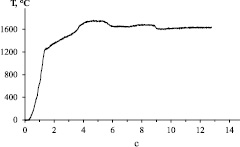
Рис. 1. Типичная термограмма горения состава с «n» = 2,75
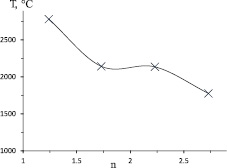
Рис. 2. Зависимость максимальной температуры горения от избытка кальцийсодержащего компонента «n»
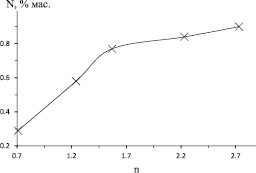
Рис. 3. Зависимость содержания азота в продукте горения после кислотного обогащения от избытка кальцийсодержащего компонента (n)
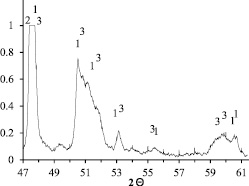
Рис. 4. Фрагмент рентгенограммы продукта горения смеси с n = 2,75: 1 – Ni2Mo3N; 2 – Mo; 3 – NiMo
После растворения соединений кальция в растворе соляной кислоты получается порошок дисперсностью до 315 мкм. Для ряда образцов проводили разделение этого порошка на фракции 0–40, 40–125 и 125–315.
Содержание азота в фракциях получилось следующим: 0–40 – 0,78 мас. %; 40–125 – 0,47 мас. %; 125–315 – 0,097 мас. %. Содержание азота в материале, полученном после кислотного обогащения, увеличивается с уменьшением размеров частиц, что объясняется увеличением реакционной поверхности.
Остаток после кислотного обогащения состоит в основном из фаз: твердого раствора Ni в Mo, NiMo и Ni2Mo3N (рис. 4). Максимальное количество фазы Ni2Mo3N близко к 30 % мас., что соответствует содержанию азота, близкому к 1 % мас. Дальнейшее повышение содержания биметаллического нитрида в продукте, вероятно, может быть достигнуто путем уменьшения температуры горения и введения активных добавок.
Заключение
Материал, содержащий биметаллический нитрид Ni2Mo3N, может быть получен при горении смеси оксидов Ni и Mo с нитридом кальция в азоте.
Горение смеси 2NiO + 3MoO3 + (11/3)n·Ca3N2 в атмосфере азота начинается после достижения температуры плавления кальция.
С увеличением избытка нитрида кальция уменьшается температура горения и увеличивается содержание азота в продукте.
После кислотного обогащения продуктов горения остается порошок, состоящий из фаз: твердый раствор Ni в Mo, NiMo и Ni2Mo3N.
В частицах обогащенного порошка содержание азота увеличивается с уменьшением размеров частиц.
Работа выполнена при поддержке РФФИ, грант № 15-03-06862.



