Гетероциклические соединения пиперидинового ряда привлекают внимание исследователей разнообразием свойств. Производные пиперидина достаточно широко используются в медицине. К настоящему времени синтезированы и изучены десятки тысяч соединений этого ряда, более трехсот из них применяют в медицинской практике в качестве лекарственных средств. Множество соединений пиперидинового ряда с успехом применяют в клинической практике для обезболивания [1]. В последние годы полигидроксилированные пиперидины и пирролидины представляют значительный интерес в лечении таких заболеваний, как рак и диабет. Некоторые соединения из этого класса оказались перспективными для лечения вирусных инфекций, в том числе ВИЧ. Кроме синтетических аспектов проблемы, важное значение имеет определение стереохимии образующихся соединений, так как возможный физиологический эффект напрямую зависит от взаиморасположения их в пространстве [2]. По аналогии с литературными данными для получения соединений, обладающих целебными свойствами, нами ранее были осуществлены реакции нуклеофильного присоединения гидроксиламина, гидразина и его производных по карбонильной группе [3]. В их числе препараты центрального периферического нейротропного действия, средства, влияющие на сердечно-сосудистую систему (противоаритмические, антигипертензивные) спазмолитики, диуретики, бронхолитики, противоязвенные средства и ряд других. Известно, что физиологическая активность препаратов пиперидинового ряда зависит от заместителей в цикле и от строения радикалов при атоме азота [4].
В синтетическом и прикладном отношении среди производных пиперидина наибольшее значение имеют γ-пиперидоны, на основе которых созданы многие эффективные лекарственные препараты, в том числе γ замещенные пиперидины [5, 6]. Гамма-пиперидоны и их производные входят в состав морфина, димедрола, промедола, фентанила. Таким образом, в качестве лекарственных препаратов выступают многие соединения, имеющие в своем составе пиперидиновый цикл. Поэтому одной из важных причин получения и исследования γ-пиперидонов и их производных является поиск новых лекарственных препаратов, более эффективных, чем ранее известные [7].
В продолжение работ по получению новых соединений в фенилпиперидиновом ряду нами был синтезирован по методу Петренко – Критченко, усовершенствованному Балиага [8], Д.К. Ким [9], 2,6-дифенил-3-изопропилпиперидин-4-он. В качестве исходных соединений для синтеза были взяты 4-метилпентанон-2, бензальдегид и ацетат аммония. Конденсация 4-метилпентанона-2 с бензальдегидом и дальнейшая циклизация с аммиаком проходит с небольшим осмолением, вследствие чего выход 2,6-дифенил-3-изопропилпиперидин-4-она не превышает 57 % (схема синтеза № 1 – рис. 1).
Далее, в области синтеза по получению новых соединений нами был проведен синтез гидрохлорида N-(3-′м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропил-пиперидин-4-она. В качестве исходных соединений для синтеза были взяты 2,6-дифенил-3-изопропилпиперидин-4-он с м-нитроацетофеноном и параформом (схема синтеза № 2 – рис. 2).
Реакцию проводили в среде абсолютизированного этилового спирта в присутствии соляной кислоты.
Ход реакции контролировали методом тонкослойной хроматографии на окиси алюминия в системе толуол: ацетон = 1:1. В ИК-спектре поглощения гидрохлорида N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она присутствуют полосы, характерные для групп: 1719 см–1 (С = 0), 1207 см–1 (С–N), 1535 см–1 (NО2), 2557 см–1 (–NH+).
Нами был осуществлен синтез по реакции нуклеофильного присоединения гидрохлоридов: гидроксиламина, семикарбазида и фенилгидразина по карбонильным группам N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она с образованием гидрохлоридов: диоксима, дисемикарбазона и дифенилгидразона N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она.
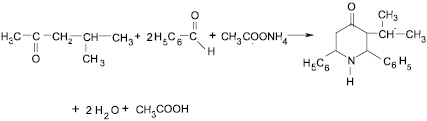
Рис. 1. Схема синтеза № 1
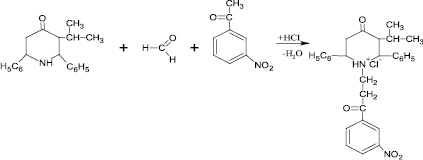
Рис. 2. Схема синтеза № 2
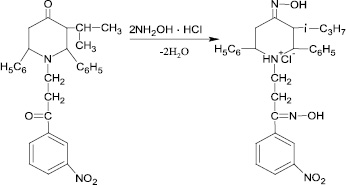
Рис. 3. Схема синтеза № 3
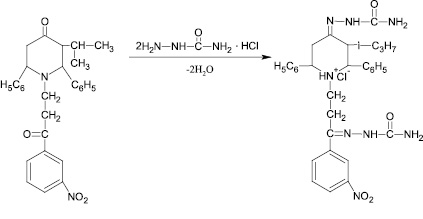
Рис. 4. Схема синтеза № 4
Гидрохлорид диоксима N-(3-′м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она получают действием cолянокислого гидроксиламина на N-(3-′м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-он (схема синтеза № 3 – рис. 3).
Синтез проводили в среде абсолютизированного этилового спирта при температуре 80 °С. В ИК спектре полученного соединения наблюдаются полосы поглощения характерные для групп: 3242 см′ (N–ОН), 1226 см′1 (С–N), 1620 см′1 (С = N), 1498 см′1 (NО2), 2485 см′1 (–N+Н). По аналогии с тем, как был получен гидрохлорид диоксима N-(3-′м-нитрофенил-31-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она, также был получен гидрохлорид семикарбазона (схема синтеза № 4 – рис. 4).
В ИК-спектре поглощения гидрохлорида дисемикарбазона N-(3-′м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она наблюдаются полосы поглощения характерные для групп: 1689 см–1 (С = 0), 1231 см•см–1 (С–N), 1649 см–1 (С = N), 1513 см–1 (NО2), 2700 см–1 (–N+Н).
Соединение N-(3-′м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропил-пиперидин-4-он взаимодействует с солянокислым фенилгидразином с образованием гидрохлорида дифенилгидразона N-(3-′м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она (схема синтеза № 5 – рис. 5).
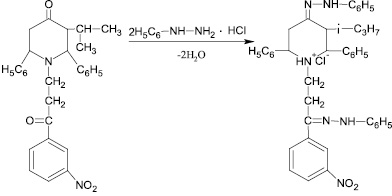
Рис. 5. Схема синтеза № 5
В качестве растворителя был использован абсолютизированный этиловый спирт. Реакционную смесь кипятят в течение 5 часов. Полученное вещество – кристаллическое соединение желтого цвета.
В ИК-спектре поглощения гидрохлорида дифенилнигидразона N-(3-′м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она наблюдается полоса поглощения характерная для групп: 1275 см–1 (С–N), 1620 см–1 (С = N), 1498 см–1 (NО2), 2337 и 2360 см–1 (–N+Н).
Синтез 2,6-дифенил-3-изопропилпиперидин-4-она
В круглодонной колбе емкостью 500 мл, снабженной обратным холодильником, смешивают 63 мл (0,5 моль) 4-метилпентанона-2, 102 мл (1 моль) бензальдегида, 53 г (0,7 моль) уксуснокислого аммония и 100 мл этилового спирта. Смесь нагревают при температуре 40–45 °С в течение 4–5 ч, перемешивая. По окончании реакции реакционную смесь охлаждают до комнатной температуры и оставляют на сутки для кристаллизации, предварительно отделив нижний слой. Выпавшие кристаллы отфильтровывают под вакуумом на воронке Бюхнера, промывают изопропиловым спиртом и высушивают. Перекристаллизовывают из ацетона.
Получают 84 г (57 %) белого кристаллического 2,6-дифенил-3-изопропил пиперидин-4-она с Тпл = 119–121 °С, Rf = 0,83 в системе бензол: диоксан = 40:1.
ИК-спектр: 3026 см–1 (Сар–Н), 1702 см–1 (С = 0), 3300 см–1 (N–H).
Общая формула: C20H23NO. Вычислено: N = 4,78 %; найдено: N = 4,14 %.
Синтез гидрохлорида N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она
В круглодонной колбе емкостью 500 мл, снабженной обратным холодильником в 300 мл абсолютизированного этилового спирта растворяют 87,9 г (0,3 моль) 2,6-дифенил-3-изопропилпиперидин-4-она 49,5 г (0,3 моль), м-нитроацетофенона и параформа 15 г в присутствии соляной кислоты. Реакционную смесь кипятят при температуре 80 °С в течение 8 часов, периодически перемешивая. Ход реакции контролируют тонкослойной хроматографией на окиси алюминия в системе толуол:ацетон = 1:1. По окончании реакции смесь охлаждают до комнатной температуры и оставляют в эксикаторе с гидроксидом натрия для кристаллизации. Выпавшие кристаллы отфильтровывают и перекристаллизовывают из толуола.
Получают 48,3 г (55 %) белого кристаллического гидрохлорида N-(3′-м-нитро-фенил-31-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она с Тпл = 210 °С.
Rf = 0,87 в системе толуол:ацетон = 1:1.
Общая формула: C29H30N2O4. Вычислено: N = 5,95 %; найдено: N = 5,27 %.
ИК-спектр: 3064 см–1 (Сар–Н), 1719 см–1 (С=О), 1207 см–1 (C–N), 1535 см–1 (NO2), 2557 см–1 (–N+H) .
Синтез гидрохлорида диоксима N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она
В круглодонной колбе, снабженной обратным холодильником, в 10 мл абсолютизированного этилового спирта растворяют 0,1 г (0,2 ммоль) гидрохлорида N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она и 0,1 г (0,4 ммоль) солянокислого гидроксиламина. Реакционную смесь кипятят в течение 5 часов, периодически перемешивая. Ход реакции контролируют тонкослойной хроматографией на окиси алюминия в системе бензол: диоксан (40:1). По окончании реакции смесь охлаждают до комнатной температуры и оставляют на сутки для кристаллизации. Выпавшие кристаллы отфильтровывают, промывают этиловым спиртом и высушивают. Перекристаллизуют из ацетона.
Получают 0,05 г (50 %) белого кристаллического гидрохлорида оксима N-(3′-m-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она с Тпл = 218–220 °С. Rf = 0,5l в системе бензол:диоксан = 40:1.
ИК-спектр: 3040 см–1 (Сар–Н), 3242 см–1 (N–OH), 1226 см–1 (C–N), 1620 см–1 (C=N), 1498 см–1 (NО2), 2485 см–1 (–N+H).
Синтез гидрохлорида дисемикарбазона N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она
В круглодонной колбе, снабженной, обратным холодильником, в 10 мл абсолютизированного этилового спирта растворяют 0,1 г (0,2 ммоль) гидрохлорида N-(3-m-нитрофенил-3-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она и 0,1 г (1 ммоль) семикарбазида солянокислого. Реакционную смесь кипятят в течение 19 часов, периодически перемешивая. Ход реакции контролируют тонкослойной хроматографией на окиси алюминия в системе бензол:диоксан = 40:1. По окончании реакции смесь охлаждают до комнатной температуры и оставляют на сутки для кристаллизации. Выпавшие кристаллы отфильтровывают, промывают этиловым спиртом и высушивают. Перекристаллизовывают из ацетона. Получают кристаллы желтого цвета гидрохлорида дисемикарбазона N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропил-перидин-4-она с Тпл = 213–215 °С. Rf = 0,38 в системе бензол: диоксан = 40:1.
ИК-спектр: 3064 см–1 (Сар–Н), 1689 см–1 (С=0), 1231 см–1 (C–N), 1649 см–1 (C=N), 1513 см–1 (NО2), 2700 см–1 (–N+H).
Синтез гидрохлорида дифенилгидразона N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-З-изопропилпиперидин-4-она
В круглодонной колбе, снабженной обратным холодильником, в 10 мл абсолютизированного этилового спирта растворяют 0,1 г (0,2 ммоль) гидрохлорида N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она и 0,1 г (1 ммоль) солянокислого фенилгидразина. Реакционную смесь кипятят в течение 5 часов, периодически перемешивая. Ход реакции контролируют тонкослойной хроматографией на окиси алюминия в системе бензол:диоксан = 40:1. По окончании реакции смесь охлаждают до комнатной температуры и оставляют на сутки для кристаллизации. Выпавшие кристаллы отфильтровывают, промывают этиловым спиртом и высушивают. Перекристаллизовывают из ацетона. Получают гидрохлорид дифенилгидразона N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропилпиперидин-4-она с Тпл = 224–230 °С, Rf = 0,74 в системе бензол:диоксан = 40:1.
ИК-спектр: 3032 см–1 (Сар–Н), 1275 см–1 (С–N), 1637 см–1 (С=N), 1498 см–1 (NО2), 2337 и 2360 см–1 (–N+H).
По программе PASS (Prediction of Activity Spectra for Subctances) [10] для синтезированных соединений был осуществлен компьютерный прогноз биологической активноcти. По результатам этого прогноза гидрохлорид N-(3′-м-нитрофенил-3′-оксопропил)-2,6-дифенил-3-изопропил-пиперидин-4-она обладает противоэкземной активностью. Для гидрохлорида диоксима высока вероятность антигипоксантных свойств.



