Ранее [1–3] был получен ряд биядерных комплексов платины и палладия с тиоцианатными, бромидными и иодидными мостиками. Учитывая достаточно высокую прочность синтезированных комплексов и их низкую растворимость, встал вопрос о поиске метода, позволяющего определять содержание ацидолигандов.
Авторами работы [4] предложен метод ионной хроматографии для одновременного определения содержания хлора, фтора, йода и брома. Однако он применим только для анализа органических соединений. В работе [5] представлена цветометрическая методика определения ионов хлора в водных растворах, основанная на окислении хлорид-ионов с последующей экстракцией хлора. Известно о применении метода ионометрии для определения бромидов, хлоридов и нитратов в лекарственном растительном сырье [6]. Для определения тиоцианат-ионов предложен метод капиллярного электрофореза [7]. Однако описанные методы предполагают присутствие в растворе либо растворимого соединения, либо свободных галогенид- и тиоцианат-ионов.
Основываясь на результатах исследования реакций замещения лигандов, нами были разработаны методы анализа биядерных комплексов платины (II) и палладия (II), позволяющие определять содержание ацидолигандов с достаточной точностью и при их совместном присутствии. Разработанная методика не требует использования дорогостоящего оборудования и реактивов, доступна и проста в исполнении, что особенно актуально при проведении большой серии исследований с целью мониторинга процесса комплексообразования.
Определение содержания галогенид- и тиоцианат-ионов
Необходимым этапом в методике анализа комплексных соединений является разрушение связей центрального атома с лигандами. В ходе изучения реакционной способности синтезированных биядерных соединений платины и палладия было показано, что полное вытеснение ацидолигандов (Cl-, Br- и I-) из внутренней сферы может быть достигнуто действием избытка аммиака или этилендиамина (en), например:
[Br2Pt(µ-Br)2Pt(NH3)2] + NH3 изб =
= 2[Pt(NH3)4]2+ + 4Br-,
[(NH3)2Pd(µ-I)2Pd(NH3)2]Cl2 + en изб =
= 2[Pden(NH3)2]2+ + 2I- + 2Cl-.
Полное вытеснение тиоцианат-ионов из внутренней сферы комплексов происходит лишь в случае обработки комплексов избытком этилендиамина:
[Cl2Pt(µ-SCN)2Pt(NH3)2] + en изб =
= [Pten2]2+ + [Pten(NH3)2]2+ + 2SCN- + 2Cl-,
[Cl2Pt(µ-SCN)2Pt(NH3)2] + NH3 изб =
= [(NH3)2Pt(µ-SCN)2Pt(NH3)2]2+ + 2Cl-.
Это позволило разработать методику количественного определения содержания ионов SCN-, Cl-, Br- и I- в комплексных соединениях.
С этой целью навеску комплекса обрабатывали избытком концентрированного раствора этилендиамина (или аммиака) при нагревании на водяной бане. После полного растворения комплекса раствор охлаждали, нейтрализовали избыток основания разбавленной азотной кислотой.
Исследуемый раствор титровали потенциометрически раствором нитрата серебра с использованием ионселективного электрода, обратимого относительно ионов серебра (I), и хлорсеребряного электрода сравнения [8–10].
Экспериментальная часть
Определение содержания галогенид- и тиоцианат-ионов
Для потенциометрического титрования исследуемых соединений навеску комплекса (0,03–0,06 г) обрабатывали 5 см3 25 %-ного раствора аммиака (или 3 см3 70 %-ного раствора этилендиамина) при нагревании на водяной бане в течение 30–60 мин до полного растворения комплекса. Раствор охлаждали, нейтрализовали избыток основания разбавленной азотной кислотой (1 : 3) до рН = 3 по индикаторной бумаге, доводили объем раствора до 50 см3 0,3 моль/дм3 раствором NaNO3. Аминные комплексы палладия разлагаются в кислой среде, поэтому нейтрализацию растворов комплексов палладия азотной кислотой после обработки избытком этилендиамина проводили только до рН = 7.
В исследуемый раствор погружали ионселективный электрод, обратимый относительно ионов серебра (I), марки «Эком-Ag» (или марки «ХС-Ag-001»), откалиброванный по стандартным растворам нитрата серебра, и хлорсеребряный электрод сравнения. Хлорсеребряный электрод соединяли с исследуемым раствором через солевой мостик, заполненный 0,3 моль/дм3 раствором NaNO3.
Исследуемый раствор титровали потенциометрически раствором нитрата серебра с = 0,025 моль/дм3. Измерения концентрации ионов Ag+ производили на иономере-кондуктометре марки АНИОН-410.
Предварительно проводили титрование смеси 0,0120 г KCl и 0,0156 г KCNS (взятых в эквимольных количествах), растворенных в 50 см3 0,3 М раствора NaNO3, раствором 0,025 М AgNO3. На кривой титрования наблюдаются два четких скачка при потенциалах 160 и 330 мВ (Ag-селективный электрод марки «Эком-Ag»). Расход титранта до первого скачка (на осаждение SCN--группы) V1 = 6,4 см3, расход титранта до второго скачка (на осаждение хлорид-ионов) V2 = 6,4 см3. На рис. 1 приводится кривая титрования комплекса (0,0454 г) [(NH3)2Pt(SCN)2Pt(NH3)2]Cl2. По кривой титрования может быть найдено содержание тиоцианатных групп и хлора при их совместном присутствии.
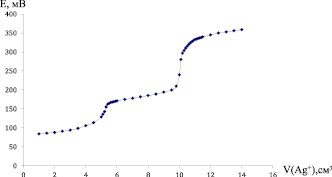
Рис. 1. Кривая потенциометрического титрования биядерного комплекса [(NH3)2Pt(SCN)2Pt(NH3)2]Cl2
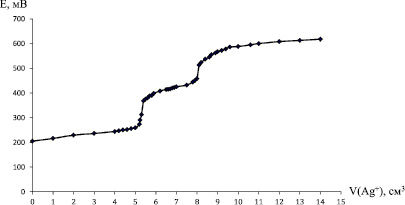
Рис. 2. Кривая потенциометрического титрования биядерного комплекса [Cl(NH3)2PtBrPtm2Br](NO3)
В табл. 1 приведены результаты титрования некоторых биядерных комплексов с тиоцианатными мостиками.
Таблица 1
Результаты титрования биядерных комплексов с тиоцианатными мостиками
|
Исследуемое соединение |
Навеска, г |
Расход титранта*, см3 |
Содержание SCN, % |
Содержание Cl, % |
|||
|
до I скачка |
до II скачка |
найдено |
абсолютная погрешность |
найдено |
абсолютная погрешность |
||
|
[(NH3)2Pt(SCN)2Pt(NH3)2]Cl2 |
0,0530 0,0485 0,0454 0,0500 0,0650 0,0430 0,0350 |
6,7 6,1 5,5 6,3 8,2 5,3 4,3 |
6,8 6,1 5,5 6,2 8,3 5,2 4,4 |
18,36 18,26 17,59 18,30 18,32 17,90 17,84 |
0,36 0,26 0,41 0,30 0,32 0,10 0,16 |
11,39 11,16 10,75 11,01 11,33 10,73 11,16 |
0,39 0,16 0,25 0,01 0,33 0,27 0,16 |
|
ДИ** = 18,08 ± 0,42 теоретическое содержание 18,00 |
ДИ = 11,08 ± 0,37 теоретическое содержание 11,00 |
||||||
|
[Cl2Pt(SCN)2Pt(NH3)2] |
0,0379 0,0518 0,0449 0,0550 0,0435 0,0505 0,0410 |
5,2 6,7 6,0 7,1 5,8 6,6 5,5 |
5,1 6,7 6,1 7,0 5,9 6,6 5,5 |
19,41 18,78 19,40 18,74 19,36 18,95 19,48 |
0,41 0,22 0,40 0,26 0,36 0,05 0,48 |
11,64 11,48 12,06 11,30 12,04 11,60 11,91 |
0,03 0,13 0,45 0,31 0,43 0,01 0,30 |
|
ДИ = 19,16 ± 0,45 теоретическое содержание 19,00 |
ДИ = 11,72 ± 0,41 теоретическое содержание 11,61 |
||||||
|
[Pt(NH3)4][Cl2Pt(SCN)2Pt(SCN)2] |
0,0501 0,0480 0,0500 0,0435 0,0473 0,0538 0,0399 |
8,4 8,1 8,2 7,4 7,8 9,1 9,6 |
4,2 4,0 4,1 3,8 3,8 4,5 3,4 |
24,34 24,50 23,81 24,70 23,94 24,56 24,02 |
0,05 0,21 0,48 0,41 0,35 0,27 0,27 |
7,44 7,40 7,28 7,75 7,13 7,42 7,56 |
0,02 0,02 0,14 0,33 0,29 0,00 0,14 |
|
ДИ = 24,27 ± 0,48 теоретическое содержание 24,29 |
ДИ = 7,43 ± 0,28 теоретическое содержание 7,42 |
||||||
Примечание. *Раствор AgNO3 c = 0,025 моль/дм3. **Доверительный интервал определяемой величины ДИ =  .
.
Определение содержания хлорид-, бромид- и иодид-ионов потенциометрическим титрованием проводили с использованием сереброселективного электрода марки «ХС-Ag-001», откалиброванного по стандартным растворам нитрата серебра, и хлорсеребряного электрода сравнения на иономере-кондуктометре марки АНИОН-4145.
Предварительно проводили титрование смеси KI, KBr, KCl, взятых в эквимольных количествах, раствором нитрата серебра с = 0,025 моль/дм3. Навески 0,010 г KCl, 0,016 г KBr и 0,022 г KI растворяли в 50 см3 0,3 моль/дм3 раствора NaNO3. На кривой титрования наблюдаются три четких скачка при потенциалах 60, 350 и 450 мВ. Расход титранта до первого скачка (осаждение I-) V1 = 5,4 см3, расход титранта до второго скачка (осаждение Br-) V2 = 5,4 см3 и до третьего скачка (осаждение Cl-) V3 = 5,4 см3.
На рис. 2 приводится кривая титрования биядерного комплекса (m = 0,0500 г) [Cl(NH3)2PtBrPtm2Br](NO3) (где m – метиламин). Расход титранта до первого скачка (осаждение Br-) V1 = 5,4 см3, расход титранта до второго скачка (осаждение Cl-) V2 = 2,7 см3.
На рис. 3 приводится кривая титрования биядерного комплекса [Br2PtI2Pten] (m = 0,0350 г). Расход титранта до первого скачка (осаждение I-) V1 = 3,2 см3, расход титранта до второго скачка (осаждение Br-) V2 = 3,2 см3.
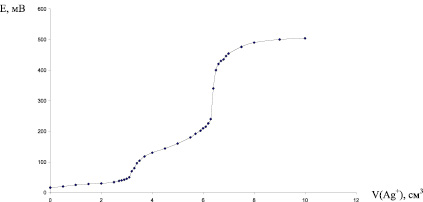
Рис. 3. Кривая потенциометрического титрования биядерного комплекса [Br2PtI2Pten]
В табл. 2 приведены результаты титрования некоторых биядерных комплексов с галогенидными мостиками. Статистическая обработка результатов анализа показала, что погрешности в определении галогенид- и тиоцианат-ионов с применением данной методики не превышают погрешностей в определении этих ионов в других комплексах традиционными методами. Исследование мономерных комплексов родия и иридия показало возможность применения данной методики для количественного определения галогенид- и тиоцианат-ионов в комплексных соединениях других металлов.
Таблица 2
Результаты титрования биядерных комплексов с галогенидными мостиками
|
Соединение |
Навеска, г |
Расход титранта*, см3 |
Содержание I, % |
Содержание Br, % |
Содержание Cl, % |
||||
|
до I скачка |
до II скачка |
найдено |
абсолютная погрешность |
найдено |
абсолютная погрешность |
найдено |
абсолютная погрешность |
||
|
[Br2Pt(µ–I2)Pten] |
0,0350 |
3,2 |
3,2 |
29,03 |
0,37 |
18,29 |
0,22 |
– |
|
|
0,0460 |
4,3 |
4,3 |
29,68 |
0,28 |
18,70 |
0,19 |
|||
|
0,0484 |
4,5 |
4,5 |
29,55 |
0,15 |
18,61 |
0,10 |
|||
|
0,0454 |
4,2 |
4,3 |
29,41 |
0,01 |
18,96 |
0,45 |
|||
|
0,0515 |
4,8 |
4,8 |
29,59 |
0,19 |
18,64 |
0,13 |
|||
|
0,0443 |
4,1 |
4,2 |
29,39 |
0,02 |
18,96 |
0,45 |
|||
|
0,0512 |
4,8 |
4,7 |
29,77 |
0,37 |
18,36 |
0,15 |
|||
|
ДИ** = 29,49 ± 0,23 теоретическое содержание 29,40 |
ДИ = 18,65 ± 0,24 теоретическое содержание 18,51 |
– |
|||||||
|
[(NH3)2Pt(µ–I2)Pt(NH3)2]Cl2 |
0,0503 |
5,1 |
5,2 |
32,19 |
0,01 |
– |
9,18 |
0,01 |
|
|
0,0435 |
4,4 |
4,5 |
32,12 |
0,08 |
9,18 |
0,01 |
|||
|
0,0520 |
5,2 |
5,3 |
31,75 |
0,44 |
9,05 |
0,12 |
|||
|
0,0445 |
4,5 |
4,6 |
32,11 |
0,08 |
9,17 |
0,01 |
|||
|
0,0505 |
5,1 |
5,3 |
32,10 |
0,09 |
9,32 |
0,15 |
|||
|
0,0489 |
4,9 |
5,0 |
31,82 |
0,38 |
9,08 |
0,10 |
|||
|
0,0438 |
4,5 |
4,6 |
32,66 |
0,47 |
9,33 |
0,16 |
|||
|
ДИ = 32,11 ± 0,27 теоретическое содержание 32,19 |
– |
ДИ = 9,19 ± 0,10 теоретическое содержание 9,17 |
|||||||
|
[Cl(NH3)2Pt(µ–Br)Pt(m)2Br]NO3 |
0,0500 |
5,4 |
2,7 |
– |
21,60 |
0,08 |
4,79 |
0,02 |
|
|
0,0480 |
5,2 |
2,6 |
21,67 |
0,15 |
4,81 |
0,04 |
|||
|
0,0514 |
5,6 |
2,7 |
21,79 |
0,27 |
4,66 |
0,12 |
|||
|
0,0530 |
5,6 |
2,8 |
21,13 |
0,39 |
4,69 |
0,08 |
|||
|
0,0466 |
5,1 |
2,6 |
21,89 |
0,37 |
4,95 |
0,18 |
|||
|
0,0600 |
6,6 |
3,3 |
22,00 |
0,48 |
4,88 |
0,11 |
|||
|
0,0550 |
6,0 |
3,1 |
21,82 |
0,30 |
5,01 |
0,23 |
|||
|
– |
ДИ = 21,70 ± 0,26 теоретическое содержание 21,52 |
ДИ = 4,83 ± 0,12 теоретическое содержание 4,77 |
|||||||
Примечание. *Раствор AgNO3 c = 0,025 моль/дм3. **Доверительный интервал определяемой величины ДИ = 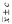 .
.
Заключение
Таким образом, метод количественного определения ацидолигандов, основанный на потенциометрическом титровании нитратом серебра раствора, полученного обработкой избытком этилендиамина или аммиака навески комплекса, позволяет найти содержание тиоцианатных групп, хлорид-, бромид- и иодид-ионов при их совместном присутствии. Кроме того, по величине потенциала можно судить о качественном составе ацидолигандов комплексного соединения. Количественное определение ацидолигандов комплексных соединений иридия и родия показало возможность применения данной методики для изучения других комплексных соединений, как мономерных, так и димерных.



