Основным качественным показателем пигментов и красителей является колористическая концентрация, зависящая от многих факторов одним из которых является присутствие водорастворимых солей в составе паст готового продукта, образующихся в результате синтеза. Удаление водорастворимых примесей один из путей повышения качественных показателей пигментов.
Из всего многообразия методов удаления водорастворимых солей из осадков можно выделить следующие: репульпация, промывка на фильтре, декантация.
Декантация является одним из самых простых и бережных к структуре кристаллов пигмента методов очистки, суть которого заключается в разделении твердой и жидкой фаз отстаиванием.
С целью определения количества циклов отмывки для достижения заданной концентрации водорастворимых солей в пасте пигмента была разработана математическая модель процесса удаления водорастворимых солей из суспензии органических пигментов.
При разработке математической модели принимаем следующие допущения: масса водорастворимых солей мала по сравнению с массой воды и твердых частиц; за время цикла (перемешивания с отстаиванием) градиентом концентрации водорастворимой соли в объеме суспензии пренебрегаем; характер зависимости, связывающей равновесные концентрации водорастворимых солей в пасте и растворе, линейный; объем пасты во всех циклах промывки постоянен; пигмент представляет собой шарообразную частицу радиусом r0.
Суспензии и осадки пигментов и красителей проявляют электрокинетические свойства, которые оказывают влияние на процессы удаления водорастворимых солей [1-3]. Мелкие частицы твердой фазы (пигмента) размером в несколько микрон и менее несут на себе электрический заряд относительно окружающей их водной дисперсионной среды [4], который возникает в результате избирательной адсорбции ионов одного определенного знака, ионизации поверхности или за счёт адсорбции на поверхности полярных молекул [2]. Возникающая таким образом система пространственно разделенных зарядов на границе раздела фаз (пигмент-раствор (полярная жидкость)) представляет собой двойной электрический слой[3,4]. Комплекс - частичка пигмента в дисперсной фазе с окружающим его двойным электрическим слоем представляет собой мицеллу. Агрегат, находящийся внутри мицеллы, представляет собой твердую фазу (частица пигмента), ядро мицеллы составляют пигмент с потенциалопределяющими ионами, состоящими из ионов хлора Cl-. Ядро в совокупности с адсорбционным слоем образуют частицу, которая окружена диффузионным слоем. Поэтому состав мицеллы можно представить следующим образом:
{[(Пигмент)nmCl-]xNa+}(m-x)Na+
где n - число молекул пигмента; m - число потенциалопределяющих ионов хлора; x - число ионов натрия в адсорбционном слое.
Количество водорастворимой соли на поверхности ядра мицеллы складывается из количества противоионов водорастворимой соли в адсорбционном слое и диффузионном слое мицеллы:
![]() (1)
(1)
где ![]() - количество водорастворимых солей на поверхности ядра мицеллы, кмоль;
- количество водорастворимых солей на поверхности ядра мицеллы, кмоль; ![]() - количество водорастворимых солей в диффузионном слое мицеллы, кмоль;
- количество водорастворимых солей в диффузионном слое мицеллы, кмоль; ![]() - количество водорастворимых солей в адсорбционном слое мицеллы, кмоль.
- количество водорастворимых солей в адсорбционном слое мицеллы, кмоль.
В диффузионном слое количество противоионов водорастворимой соли на поверхности частицы в мицелле в интегральной форме:
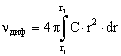 (2)
(2)
где C - концентрация противоионов в диффузионной области, кмоль/м3; r - расстояние от поверхности частицы пигмента, м; r1 - граница слоя адсорбции, м; r3 - граница диффузионного слоя, м.
В адсорбционном слое количество противоионов водорастворимой соли на поверхности ядра в мицелле с учетом максимально возможного количества противоионов:
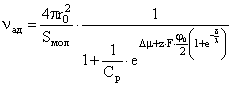 (3)
(3)
где r0 - радиус ядра мицеллы, м; ![]() - площадь занимаемая одним противоионом, м2; Δμ - изменение химического потенциала вещества при переходе из раствора в адсорбционный слой, Дж/моль; φ - разность потенциалов в данной точке и в объеме жидкости (на «бесконечном» удалении от поверхности), Дж/Кл; λ - толщина диффузионного слоя, м; δ - толщина слоя адсорбции, м; F - постоянная Фарадея, Кл; z - заряд ионов.
- площадь занимаемая одним противоионом, м2; Δμ - изменение химического потенциала вещества при переходе из раствора в адсорбционный слой, Дж/моль; φ - разность потенциалов в данной точке и в объеме жидкости (на «бесконечном» удалении от поверхности), Дж/Кл; λ - толщина диффузионного слоя, м; δ - толщина слоя адсорбции, м; F - постоянная Фарадея, Кл; z - заряд ионов.
Подставим в уравнение (1) уравнения (2)-(3):
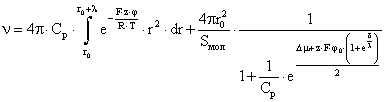 (4)
(4)
где R - газовая постоянная, Дж/(моль×К); T - абсолютная температура, К.
Материальный баланс по количеству водорастворимой соли для процессов отстаивания и декантации, которое складывается из количества водорастворимой соли на твердом материале (пигменте) и в растворе составит:
![]() (5)
(5)
где ![]() - общее количество водорастворимых солей в суспензии пигмента, кмоль;
- общее количество водорастворимых солей в суспензии пигмента, кмоль; ![]() - количество водорастворимых солей в растворе, кмоль;
- количество водорастворимых солей в растворе, кмоль; ![]() - количество водорастворимых солей во всем объеме пигмента, кмоль;
- количество водорастворимых солей во всем объеме пигмента, кмоль; ![]() - количество водорастворимых солей на поверхности одной частички пигмента, кмоль;
- количество водорастворимых солей на поверхности одной частички пигмента, кмоль; ![]() - объем пасты, м3;
- объем пасты, м3; ![]() - количество частиц пигмента, шт/м3;
- количество частиц пигмента, шт/м3; ![]() - объемная доля пигмента в пасте.
- объемная доля пигмента в пасте.
Полученный слой пасты после декантации доводится до объема исходной суспензии V м3 путем добавления воды в качестве растворителя, следовательно, объем внесенной воды в пасту составит ![]() м3.
м3.
При этом количество водоростворимой соли не изменилось, объем пасты остался постоянным, объем воды в растворе увеличился на ![]() .
.
Следовательно, материальный баланс процесса разбавления пасты растворителем (водой) можно записать в виде:
![]() (6)
(6)
где V - объем исходной суспензии, м3; Vp - объем раствора, м3.
Концентрация водорастворимых солей в растворителе (вода) становится равной ![]() , когда количество вещества этих солей не изменяется
, когда количество вещества этих солей не изменяется
Концентрация водорастворимых солей в растворителе (вода) ![]() находится итерационным путем (методом последовательных приближений).
находится итерационным путем (методом последовательных приближений).
1-ое приближение формируется из предположительного разбавления только раствора.
1-ый итерационный шаг. Находим концентрацию соли в растворе ![]() при первом разбавлении исходя из концентрации соли в исходном растворе (декантате)
при первом разбавлении исходя из концентрации соли в исходном растворе (декантате) ![]() и объемов исходной суспензии V м3и пасты Vn м3:
и объемов исходной суспензии V м3и пасты Vn м3:
![]() (7)
(7)
где ![]() = Cp - мольная концентрация водорастворимых солей в растворителе, кмоль/м3.
= Cp - мольная концентрация водорастворимых солей в растворителе, кмоль/м3.
Рассчитываем количество водорастворимых солей на поверхности пигмента:
![]() (8)
(8)
Где количество одной частицы пигмента ![]() определяем по уравнению (4).
определяем по уравнению (4).
2-ой итерационный шаг. Находим концентрацию соли в растворе при первом разбавлении исходя из количеств водорастворимых солей в суспензии пигмента и на поверхности пигмента при первом разбавлении:
![]() (9)
(9)
Процесс последовательных приближений для уравнений (7)-(9) проводится до момента, когда разницы между итерациями для ![]() рассчитываемое по уравнению (7) и
рассчитываемое по уравнению (7) и ![]() - по уравнению (9) не превысит заданное число.
- по уравнению (9) не превысит заданное число.
Концентрация водорастворимых солей в растворе и на поверхности пигмента не изменяется, изменяется объем раствора за счет декантации, и следовательно общее количество солей, тогда материальный баланс процесса отстаивания суспензии и декантации дисперсионной фазы (раствора) можно записать:
![]() (10)
(10)
Эти данные используем для следующего процесса разбавления. Расчет повторяем пока концентрация ![]() примет значение меньше либо равно требуемой.
примет значение меньше либо равно требуемой.
Предложенная методика позволяет рассчитать технологические параметры процесса удаления водорастворимых солей из суспензий азопигментов методом декантации и отстаивания.
СПИСОК ЛИТЕРАТУРЫ
- Малиновская, Т.А. Разделение суспензий в промышленности органического синтеза / Т.А. Малиновская. - М.: Химия, 1972. - 320 с.
- Лукомский, Ю.Я., Гамбург, Ю.Д. Физико-химические основы электрохимии: учебник / Ю.Я. Лукомский, Ю.Д. Гамбург - М.: ИД Интеллект, 2008. - 424c.
- Дамаскин, Б.Б., Петрий, О.А. Введение в электрохимическую кинетику / Б.Б. Дамаскин, О.А. Петрий. 2 изд., - М.: Высшая школа, 1983. - 400 с.
- Захарченко, В.Н. Коллоидная химия: учебник для вузов / В.Н. Захарченко - М.: Высшая школа, 1989. - 238 с.



