К настоящему времени изучено поведение 1,1-дигалогенпроизводных фенил- и бензилциклопропанов в условиях нитрозирования. Показано, что галогенпроизводные фенилциклопропана в условиях нитрозирования трансформируются либо в продукты размыкания малого цикла [3], либо гетероциклические соединения [1, 2]. Бензилциклопропановые производные претерпевают наряду с гетероциклизацией нитрование в ароматическое ядро. На результат превращений влияет как соотношение реагентов, так и природа галогена [1].
Цель исследования. С целью расширения синтетических возможностей арилциклопропанов представлялось интересным изучение поведения других производных фенилциклопропана в условиях нитрозирования и выявления факторов, влияющих на направление реакции.
Нами был синтезирован гем-замещённый фенилциклопропан принципиально другого характера – 1,1-диметокси-2-фенилциклопропан (1) и изучено его поведение в условиях реакции нитрозирования. Варьировались температура и соотношение реагентов. Как показал эксперимент, природа субстрата внесла существенные корректировки в изучаемую реакцию, что, несомненно, расширяет синтетические возможности как системы нитрит натрия – трифторуксусная кислота, так и уникальных циклопропанов. Проведённые эксперименты выявили неоднозначное протекание реакции, и нами были выделены как продукты гетероциклизации, так и продукты раскрытия малого цикла (схема 1).
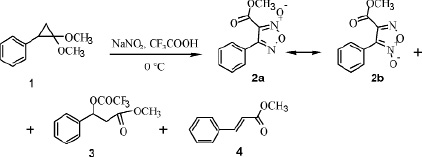
Схема 1
Образование изомерных метил-4-фенил-3-фуроксанкарбоксилатов (2) можно объяснить предложенной схемой (схема 2):
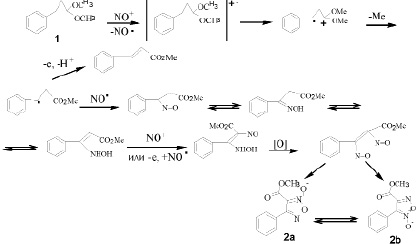
Схема 2
Спектры ЯМР 1Н и 13C регистрировали на спектрометре «Varian VXR-400» в CDCl3. В качестве внутреннего стандарта использовали остаточный сигнал CHCl3 (δ 7.25, м. д). ИК спектры записывали на спектрофотометре UR-20 в интервале 400-3600 см-1 в вазелиновом масле. Масс-спектры получали на приборе Finnigan SSQ 7000 (типа GC-MS) с использованием капиллярной колонки (30 м х 2 мм, неподвижная фаза DВ-1), газ-носитель – гелий (40 мл/мин) и программированием температуры от 50 до 300 °С (10 град/мин). Энергия ионизации 70 эВ. Элементный анализ проведён на анализаторе фирмы Carlo Erba 1106. Разделение реакционных смесей и контроль чистоты продуктов реакции проводили на колонках или на пластинах в тонком слое, носитель – силикагель L40/100 мкм (Чехия), используя элюент Et2O-петролейный эфир (40-70 °С), 1:3 (по объему).
1,1-Диметокси-2-фенилциклопропан (1). К раствору 25 г KOH в 100 мл метанола при 80 оС и перемешивании добавляют 9.3 г (0.05 моль) 1,1-дихлор-2-фенилциклопропана. Нагревают до 105 оС и через 10 мин. выливают в воду и экстрагируют пентаном. Экстракт сушат над CaCl2 и перегоняют под вакуумом. Получают 4.6 г (52 %) 1,1-диметокси-2-фенилциклопропана (1). Т. кип. 68-69 оС (0.42 мм рт.ст.), 1.5121. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.36-1.39 (1Н, кв), 1-49-1.53 (1Н, кв), 2.46-2.50 (1Н, м), протоны циклопропана, 3.29 (3Н, с, OCH3), 3.52 (3Н, с, OCH3), 7.28-7.44 (5Н, м, ArH) [5].
Получение соединений (2-4). К раствору 0.005 моль (0.94 г) 1,1-диметокси-2-фенилциклопропана (1), 2.50 г CF3COOH и 10 мл CHCl3 при 0÷5 °С порциями добавляли 0.35 г (0.005 моль) NaNO2. Реакционную смесь перемешивали при 0 °С в течение 30 – 40 мин, выливали в 70 мл холодной воды, хлороформный слой отделяли, водный нейтрализовали Na2CO3 и экстрагировали CHCl3 (2 х 10 мл), хлороформные растворы объединяли, промывали водой, сушили CaCl2 и, упарив растворитель, остаток сначала анализировали ЯМР 1Н, а затем хроматографировали на пластинках с Al2O3 [элюент: Et2O-CHCl3-петролейный эфир (40-70 °С), 1:1:3]. Получали: смесь метил-4-фенил-3-фуроксанкарбоксилатов (2a, 2b). Выход 0.22 г (20 %). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.93 (3Н, с, OCH3), 4.01 (3Н, с, OCH3), 7.51-7.71 (5Н, м, ArH). Спектр ЯМР 13С, d, м. д: 29.97 (С1a), 53.2 (OCH3), 24.46 (С1b), 34.26 (С6), 108.40 (С5), 122.55 (С2), 133.18 (С3), 137.0 (С6а), 152.6 (С4), 157.9 (СO). Rf 0.5 (элюент петролейный эфир-Et2O, 2:1) [4]. Масс-спектр, m/z (Iотн, %): 220 [M]+ (8.0), 190 (27.5), 160 (41.6), 129 (100), 119 (10.0), 102 (62.5), 75 (12.5), 51 (16.6), 39 (7.0). Найдено, %: С 54.42; Н 3.54; N 12.32. С10Н8N2O4. Вычислено, %: С 54.55; Н 3.66; N 12.72.
Метил-3-трифторацетоксидигидроцинамат (3). Выход 0.35 г (25 %). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 2.83 (1Н, д. д, 3J = 10, 3J = 4.5), 3.05 (1Н, д. д, 3J = 10, 3J = 7), 3.69 (3Н, с), 6.27 (1Н, д. д, 3J = 7, 3J = 4.5), 7.38 (5Н, с, ArH). Масс-спектр, m/z (Iотн, %): 276 [M]+ (39.2), 216 (100), 203 (35.8), 179 (29.2),131 (40.0), 121 (33.3), 105 (90.0), 91 (18.0), 77 (31.8), 69 (30.1), 51 (18.3) [6].
Метилцинамат (4). Выход 0.40 г (49 %). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.83 (1Н, с, COOCH3), 6.48 (1Н, д, J = 16, Н-2), 7.29-7.53 (5Н, м, ArH), 7.72 (1Н, д, J = 16, Н-3). Rf 0.5 (петролейный эфир-Et2O, 2:1). Масс-спектр, m/z (Iотн, %): 163 [M]+ (14.6), 131 (14.0), 121 (100), 104 (68.3), 91 (30), 77 (35.0), 59 (31.8) [4].
Заключение
Найденная трансформация производных циклопропанов в практически значимые гетероциклические соединения фуроксанового ряда является первым примером подобных превращений. Детальные исследования в данном направлении продолжаются.
Работа выполнена при финансовой государственной поддержке научных исследований в Республике Северная Осетия-Алания (проект 15рк-3-2014).
Библиографическая ссылка
Газзаева Р.А., Коблова Л.Б. ВЗАИМОДЕЙСТВИЕ 1,1-ДИМЕТОКСИ-2-ФЕНИЛЦИКЛОПРОПАНА С АЗОТИСТОЙ КИСЛОТОЙ // Успехи современного естествознания. – 2014. – № 12-4. – С. 386-388;URL: https://natural-sciences.ru/ru/article/view?id=34616 (дата обращения: 20.04.2024).



