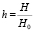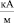Прикладные аспекты концепции раздельного ассоциирования молекул растворителя и ионов растворённых веществ в значительной мере основаны на преобладании устойчивости H-связей над разрушительным влиянием на них общей минерализации раствора. Описание взаимного влияния растворителя и растворенных веществ при проведении раздельного ассоциирования молекул и ионов является актуальной проблемой освоения гидроминеральных ресурсов.
Разрушение димерных ассоциаций растворителя может происходить как в результате преобладания осмотического давления над давлением сил резонансного взаимодействия атомов разных молекул, так и путем гидратации ассоциированными ионами. Возможности разрушения димерной структуры растворителя под влиянием высокой общей минерализации удобно исследовать на основе использования представлений о давлениях резонансной и осмотической сил в растворах [1]. Естественно, что для ассоциирования молекул растворителя необходимо предварительно произвести необратимые разрывы связей между ионами и молекулами [1–3].
В данной работе для осуществления процесса дегидратирования ионов используется постоянное магнитное поле, позволяющее достаточно просто и надёжно описать направленные процессы в водном растворе. В статье значительное внимание уделено также выявлению и обоснованию наиболее устойчивой формы ассоциаций молекул растворителя [3].
При образовании Н-связей в их энергию вносит вклад процесс переноса заряда (протона) от молекулы к молекуле. Из-за отталкивания переносимых зарядов [4] ассоциация молекул становится неустойчивой. Отсюда следует, что чем больше ассоциация молекул, тем она менее устойчива. При температурах Т ≥ Тс = 42,68 °С стабильны лишь одиночные связи (димеры).
Наблюдаемые в лабораторных условиях [4, 5] синхронные переходы протонов в локальной области радиуса R = 10-6 м осуществляют синхронное образование Н-связей. В итоге область радиуса R становится «критической» для образования димерных ассоциаций молекул растворителя во всем растворе.
Вопросы формирования димерной структуры молекул растворителя исследованы авторами, и результаты будут опубликованы.
Методика расчёта параметров раздельного ассоциирования молекул и ионов в растворе
Для осуществления раздельного ассоциирования молекул и ионов в водном растворе помимо электрического взаимодействия ионов необходимо внимательно исследовать ещё два типа взаимодействий: резонансное взаимодействие атомов разных молекул, создающее водородные связи между молекулами, и ион-дипольное взаимодействие, связанное с осмотическими силами в растворе.
Расчёт параметров резонансных сил удобно начать с определения числа синхронных переходов протонов (СПП), совершаемых в область с периметром L = 2πR. В этом случае число СПП может быть определено равенством
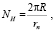 (1)
(1)
где rn – радиус ядра атома водорода.
Из-за однородности замкнутого объёма растворителя 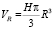 по структуре давление резонансных сил может быть представлено в виде [6]
по структуре давление резонансных сил может быть представлено в виде [6]
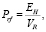 (2)
(2)
где EH = NH•εH.
В формуле (2) величина εH определяет избыточную энергию отдельной Н-связи (см. раздел «Результаты исследования и их обсуждение» и работу [7]).
Так как число протонов, перешедших в область СПП через её периметр, предполагается равным числу димеров, образовавшихся за счёт Н-связей между молекулами, то формулу (2) следует заменить на
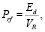 (3)
(3)
где Ed = Nd•εd, Nd = NH(2v2).
В выражении (3) фактор связи между молекулами димера определяется следующим равенством:
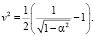 (4)
(4)
Важным следствием установления димерной структуры растворителя является значительное усиление взаимодействия ионов раствора, связанное с уменьшением диэлектрической проницаемости растворителя. Действительно, составляя закон взаимодействия ионов a и b
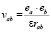
в растворителях с неассоциированными и димерно ассоциированными молекулами, получаем
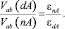 (5)
(5)
На данном этапе разработки концепции раздельного ассоциирования молекул и ионов растворов можно воспользоваться приблизительной пропорциональностью диэлектрической проницаемости ε растворителя общей минерализации раствора, т.е. равенством
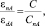 (6)
(6)
где εnА, εdА – диэлектрические проницаемости растворителей соответственно с неассоциированными и димерно ассоциированными молекулами, а С и СnА – общая минерализация раствора до и после образования ассоциаций ионов.
При определении параметров ассоциации молекул и ионов по равенствам (2) и (3) следует использовать также закон сохранения числа ионов при их ассоциировании, т.е. равенство
С = СnА + СpА, (7)
где СpА – общая минерализация попарно ассоциированных ионов.
Результаты исследования и их обсуждение
При ассоциировании молекул в отличие от дегидратации ионов внешнее магнитное поле (МП) не только определяет характер процесса, но и производит необходимое для образования Н-связей локальное сжатие.
Данная роль магнитного поля выявляется, если учесть его влияние через унитарный параметр α резонансного взаимодействия атомов разных молекул, т.е. с помощью формулы
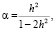 (8)
(8)
где 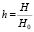 – безразмерная величина напряженности внешнего магнитного поля Н.
– безразмерная величина напряженности внешнего магнитного поля Н.
Вычисленные на основе формулы (8) и спектра значений унитарного параметра α величины внешнего магнитного поля приведены в табл. 1.
Таблица 1
Характеристики внешнего магнитного поля, создающего димерные ассоциации молекул
|
α |
|
H, |
|
0,72 0,75 0,78 0,80 |
0,543 0,547 0,551 0,554 |
325,8 328,2 330,6 332,4 |
При вычислении параметров табл. 1 использована величина характеристического магнитного поля 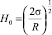 ;
; 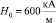 , при которой поверхностное натяжение воды σ принимает максимальное значение. Анализ данных табл. 1 показывает, что величина внешнего магнитного поля, создающего и поддерживающего димерное ассоциирование молекул, значительно превышает его величину, необходимую для придания процессу дегидратации ионов направленного характера. Таким образом, образование димеров молекул происходит при Н = 325,8
, при которой поверхностное натяжение воды σ принимает максимальное значение. Анализ данных табл. 1 показывает, что величина внешнего магнитного поля, создающего и поддерживающего димерное ассоциирование молекул, значительно превышает его величину, необходимую для придания процессу дегидратации ионов направленного характера. Таким образом, образование димеров молекул происходит при Н = 325,8 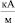 , тогда как для придания направленного характера процессу дегидратации, т.е. для его необратимости, достаточно Н порядка 80–120
, тогда как для придания направленного характера процессу дегидратации, т.е. для его необратимости, достаточно Н порядка 80–120 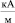 . Исследования показали, что образование Н-связей во всей дегидратированной области раствора происходит при следующих параметрах: температуре Tc = 42,68 °С и постоянном магнитном поле Нс = 325,8
. Исследования показали, что образование Н-связей во всей дегидратированной области раствора происходит при следующих параметрах: температуре Tc = 42,68 °С и постоянном магнитном поле Нс = 325,8 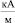 .
.
В установление димерной структуры молекул растворителя вносит свой вклад также стабилизационная энергия Н-связей. Известно, что при образовании Н-связей выделяется не вся ожидаемая энергия: часть этой энергии сохраняется в структуре Н-связи в виде конфигурационной или стабилизационной энергии. Стабилизационная энергия является избыточной по отношению к энергии Н-связи и служит источником энергии стабилизации движения связанных молекул (димеров), и в модели резонансных сил Н-связей между молекулами она определяется величиной
εН = ε0 α(1 – α), (9)
где ε0 – постоянная с размерностью энергии, не зависящая от унитарного параметра α взаимодействия атомов разных молекул.
Здесь целесообразно отметить, что одиночные Н-связи (димеры) обычно не рассматриваются как объект движения из-за их предполагаемой нестабильности. Однако из-за наличия стабилизационной энергии движение димеров может быть устойчивым в определённом интервале изменения внешних параметров. Определяемые равенствами (5–7) параметры раздельного ассоциирования молекул и ионов приведены в табл. 2.
Таблица 2
Оценка параметров раздельного ассоциирования молекул и ионов в растворе
|
Наименование параметра |
Значение параметра |
|
1. Диэлектрическая проницаемость растворителя, ε |
70 |
|
2. Диэлектрическая проницаемость растворителя с димерными ассоциациями, εdA |
5 |
|
3. Общая минерализация исходного раствора С, г/л |
35 |
|
4. Общая минерализация с парными ассоциациями ионов СpА, г/л |
32,5 |
|
5. Общая минерализация раствора с неассоциированными ионами СnА, г/л |
2,5 |
Из данных табл. 2 следует:
1. Диэлектрическая проницаемость εdА растворителя с димерными ассоциациями молекул значительно меньше диэлектрической проницаемости растворителя с неассоциированными молекулами (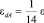 ).
).
2. Ассоциированная часть растворенных минералов из-за сильной связи между ионами в растворе с димерным типом ассоциирования молекул не способна гидравлически взаимодействовать с димерами растворителя. Эта гидравлически не активная часть общей минерализации не участвует в создании осмотического давления. Согласно равенствам (2–4), ассоциированная часть общей минерализации составляет 93 % от исходной общей минерализации раствора.
3. Гидравлически активная часть растворенных минералов составляет 7 % от исходной общей минерализации. Она участвует в создании осмотического давления и влияет на стабильность димерной структуры растворителя. С другой стороны, стабильность ассоциаций молекул растворителя обусловлена резонансными силами взаимодействия атомов разных молекул. Поэтому основные параметры раздельного ассоциирования молекул и ионов раствора удобно исследовать на основе использования представлений о давлениях резонансной и осмотической сил.
Как уже отмечалось, разрушение димерной структуры при фиксированном внешнем параметре связано либо с преобладанием осмотического давления над давлением резонансных сил (7), либо с гидравлическим влиянием молекул растворителя на ассоциированные ионы. В рассматриваемых растворах минералы находятся в ассоциированном и неассоциированном состояниях. По данным табл. 2 ассоциированная часть общего минерального состава представляет собой совокупность электронейтральных пар ионов, доля которых составляет примерно 93 % от общей минерализации, а остальная часть существует в виде одиночных ионов. Последняя гидравлически активна, влияет на стабильность димерной структуры растворителя и создаёт осмотическое давление
Posm = CnA RT. (10)
Ассоциированная часть общей минерализации гидравлически не активна, не влияет на структуру растворителя и поэтому не участвует в создании осмотического давления.
При фиксированных значениях внешних параметров стабильность димерной структуры растворителя в основном определяется соотношением давлений Prf и Рosm, определяемых равенствами (7) и (10).
Судя по свойствам ассоциированной части растворенных минералов, её влияние на структуру растворителя незначительно даже при величинах общей минерализации раствора порядка нескольких сотен г/л.
Однако для определения количественного критерия стабильности димерных ассоциаций молекул следует ещё определить наименьшее значение давления резонансных сил, создающего и поддерживающего димерную структуру растворителя.
Для определения давления Prf на основе формулы (7) используем следующие данные: α = 0,72, r = 1,4•10-15 м, R = 10-6 м, εH = 0,323•10-19Дж. В итоге получаем Prf = 346•105Па.
Из этого следует, что для разрушения димерной структуры растворителя под влиянием общей минерализации необходимо увеличить величину общей минерализации до 500 г/л и осмотическое давление должно превышать Prf. Таким образом, выяснилось, что общая минерализация С и осмотическое давление Рosm как факторы разрушения ассоциаций молекул неэффективны. Отсутствие влияния величины общей минерализации на создание ассоциаций молекул обусловлено ассоциированием ионов, которые гидравлически не активны и не участвуют в создании осмотического давления.
Из анализа процесса раздельного ассоциирования молекул и ионов вытекает целесообразность выполнения его двумя этапами: 1) выделение побочного продукта в виде ассоциированной части общего минерального состава и 2) опреснение подготовленных вод [9].
Заключение
По имеющимся данным одно из условий реализации раздельного ассоциирования молекул и ионов заключается в поддержании их в дегидратированном состоянии во всей области влияния магнитного поля на раствор. Из-за необратимости процесса дегидратации под влиянием магнитного поля можно принять, что молекулы растворителя образуют димерную структуру, если величину внешнего магнитного поля изменить со значения, необходимого для дегидратации ионов 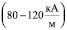 , до значения, поддерживающего ассоциирование молекул растворителя
, до значения, поддерживающего ассоциирование молекул растворителя 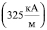 .
.
Конкретное осуществление процессов раздельного ассоциирования молекул и ионов связано с созданием в растворе локального очага радиуса R = 10-6 м, где по данным наблюдений совершаются синхронные переходы протонов и формируются водородные связи между молекулами.
Установление димерного ассоциирования молекул растворителя существенно меняет его структуру и свойства. По данным расчёта диэлектрическая проницаемость водного растворителя уменьшается примерно в 14 раз. Такое изменение диэлектрической проницаемости приводит к значительному росту взаимодействия ионов и к разделению общего количества растворенных веществ на ассоциированную и неассоциированную части, имеющие разные величины и свойства. Ассоциированная часть общей минерализации представляет собой совокупность электронейтральных ионных пар. Она не влияет на стабильность димерной структуры растворителя. Кроме того, ассоциированная часть гидравлически не активна, а поэтому она не участвует в создании осмотического давления. При этом гидравлически активная неассоциированная часть минералов составляет малую часть общей минерализации раствора. Это обстоятельство позволяет опреснять воду со значительно более высоким уровнем минерализации.
Ясно также, что ассоциированная часть общей минерализации, не влияющая на стабильность димерной структуры и гидравлически не связанная с растворителем, может быть отделена от гидравлически активной части растворителя с помощью магнитного поля.
Приведённые соображения, по нашему мнению, достаточны для постановки экспериментов по проверке ряда изложенных выводов, вытекающих из концепции раздельного ассоциирования молекул и ионов водного раствора.
В заключение отметим, что основные выводы статьи предполагается проверить методом обратного осмоса [9].
Библиографическая ссылка
Алхасов А.Б., Абдуллаев А.А., Рабаданов Г.А. ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ РАЗДЕЛЬНОГО АССОЦИИРОВАНИЯ МОЛЕКУЛ И ИОНОВ ДЛЯ ОПРЕСНЕНИЯ МИНЕРАЛИЗОВАННЫХ ВОД // Успехи современного естествознания. – 2017. – № 10. – С. 7-11;URL: https://natural-sciences.ru/ru/article/view?id=36552 (дата обращения: 18.04.2024).