Постоянный интерес к новым производным перзамещенных нитрозофенолов существует в связи с тем, что из них легко, путем восстановления, можно перейти к полностью замещенным аминофенолам [5, 8]. Такие аминофенолы проявляют различные виды биологической активности [4]. Перзамещенные нитрозофенолы получают по реакции между изонитрозо-β-дикетонами и диалкиловыми эфирами ацетондикарбоновой кислоты в щелочной среде [2] (cхема (1)).
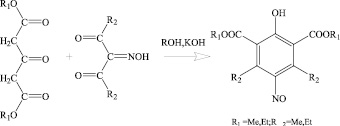 (1)
(1)
Недавно, пользуясь данным методом, удалось ввести в молекулы нитрозофенолов пиридиновые заместители [2]. Выбор таких соединений обусловлен тем, что введение пиридинового фрагмента в органические молекулы может усилить их биологическую активность [1]. В то же время на сегодняшний день совершенно не изучено поведение перзамещенных нитрозофенолов с пиридиновым заместителем в кольце в органических растворителях, в каких таутомерных формах они находятся, могут ли эти молекулы димеризоваться.
Цель исследования. Изучение структуры и физико-химических свойств перзамещенных нитрозофенолов с пиридиновым заместителем в ядре. Исследование таутомерного равновесия между нитрозофенольной и хиноноксимной формами, доказательство димеризации молекул нитрозофенола.
Материалы и методы и исследования
Структура перзамещенных нитрозофенолов с пиридиновым заместителем в кольце подтверждена спектральными методами анализа. УФ спектры записывали на спектрофотометре HELIOS OMEGA в этаноле либо в 0,1 н водном растворе едкого кали. Спектры ЯМР 1Н регистрировали в ДМСО-d6, в гексадейтероацетоне, в дейтерохлороформе и в D2O на приборе Bruker Avance III 600,13 МГц. ИК спектры получены на ИК микроскопе SpecTRA TECH InspectIR на базе ИК Фурье-спектрофотометра Impact 400. Элементный анализ выполняли на автоматическом CHNS-анализаторе EUROEA3000 [6]. Взвешивание образцов производилось на весах Sartorius CP2P (Германия).
Результаты исследования и их обсуждение
Для решения поставленной цели мы ввели изонитрозо-β-дикетоны с пиридиновым заместителем в реакцию циклизации с диметиловым и диэтиловым эфирами ацетондикарбоновой кислоты по методу [2] и получили шесть перзамещенных нитрозофенолов с пиридиновыми заместителями в виде калиевых солей (схема (2)).
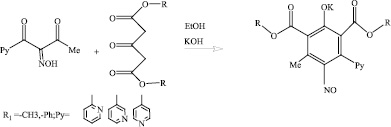 (2)
(2)
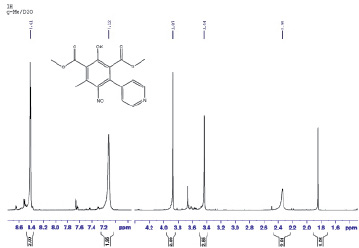
Рис. 1. Спектр ЯМР1Н в D2O 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенолята калия
Все полученные соли были кристаллическими соединениями зеленого цвета, что подтверждает их нахождение в нитрозофенольной форме, так как такая окраска обеспечивается n – π* переходом неподеленной электронной пары атома азота нитрозогруппы [7]. В связи с этим во всех электронных спектрах синтезированных солей нитрозофенолов в 0,1 н КОН присутствовал максимум поглощения в области 635–640 нм с невысоким коэффициентом молярной экстинкции ε равной 46–73. В ЯМР1Н спектрах солей в D2O присутствовали сигналы всех ароматических протонов пиридинового ядра, характерные пики алкильных групп карбоксильного заместителя и в сильном поле – синглет метильной группы кольца.
В качестве примера на рис. 1 приведен спектр 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенолята калия.
В спектре 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенолята калия видны сигналы протонов ароматического ядра пиридина в области слабого поля с химсдвигом δ7,12 и 8,41 м.д., алифатические протоны метоксикарбонильных групп с химсдвигом δ 3,44, 3,87 м.д. и метильной составляющей фенольного кольца в сильном поле с δ 2,35 м.д.. Спектры ЯМР1Н в D2O для остальных солей были аналогичны.
Полученные данные подтверждают, что соли полностью замещенных нитрозофенолов с пиридиновым заместителем и в кристаллах, и в водном растворе находятся в мономерной нитрозофенольной форме.
В то же время выделенные нами свободные нитрозофенолы в твердом состоянии не имеют зеленой окраски, по-видимому, из-за димеризации молекул по типу азодиоксидов [3], подобно тому, как димеризуются молекулы алифатических и ароматических нитрозосоединений (схема (3)).
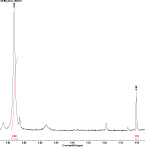
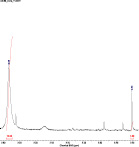
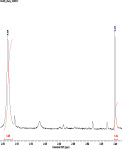
Недавно было доказано, что некоторые перзамещенные нитрозофенолы в растворе хлороформа также димеризованы, однако при разбавлении мономеризуются [3]. Мы провели исследование поведения полностью замещенных нитрозофенолов с пиридиновым заместителем методом ЯМР 1Н в растворе CDCl3. Результаты приведены на рис. 2.
В спектре наблюдаются два сигнала метильной группы кольца. Один, с химсдвигом 2,58 м.д., относящийся к димеру, другой, с химсдвигом 2,20 м.д., – к мономерной форме. При разбавлении увеличивается интегральная интенсивность сигнала метильной группы мономера, а сигнал димерной метильной группы уменьшается вплоть до полного исчезновения при большом разбавлении.
Данные, полученные методом ЯМР 1Н в дейтерохлороформе, представлены в табл. 1. С их помощью нам удалось вычислить константу равновесия для изучаемых нитрозофенолов между димерной и мономерной формами в растворе на примере 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенола.
Такое небольшое значение константы мономеризации Кр говорит о том, что в растворе СDCl3 преобладает димер и только в очень разбавленных растворах удается наблюдать мономерную форму.
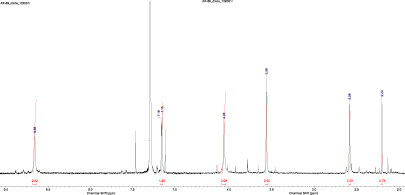
Однако в растворе DMSO-d6 картина в спектре ЯМР выглядела совершенно иной (рис. 3).
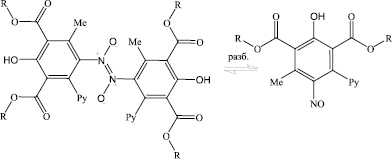 (3)
(3)
a б в
г
Рис. 2. Спектр ЯМР 1Н 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенола в дейтерохлороформе: а – при концентрации 7,96∙10–3 моль/л в области 2,2–2,8 м.д.; б – при разбавлении в 2 раза; в – при разбавлении в 4 раза; г – полный спектр нитрозофенола
Таблица 1
Соотношение мономерной и димерной форм нитрозофенола в дейтерохлороформе при различных концентрациях для 2-х параллельных серий опытов
|
Номер опыта |
Концентрация общая, моль/л |
Концентрация мономера, моль/л |
Концентрация димера, моль/л |
Кр |
|
1 |
0,0157 |
– |
0,99 |
– |
|
2 |
0,0157 |
– |
0,99 |
|
|
3 |
0,00785 |
0,128 |
0,871 |
0,128 |
|
4 |
0,00785 |
0,101 |
0,898 |
0,101 |
|
5 |
0,00398 |
0,107 |
0,892 |
0,107 |
|
6 |
0,00398 |
0,091 |
0,908 |
0,091 |
|
7 |
0,00199 |
0,235 |
0,764 |
0,235 |
|
8 |
0,00199 |
0,235 |
0,764 |
0,235 |
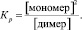
Отсюда Кр = 0,11 ± 0,02 при 25 °С.
В спектре наблюдаются все признаки того, что нитрозофенол находится не в нитрозофенольной, а в хиноноксимной форме (схема (4)).
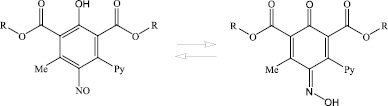 (4)
(4)
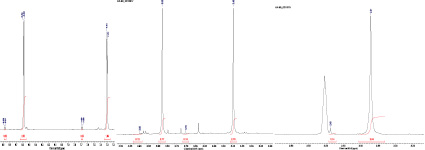
Рис. 3. Спектр ЯМР 1Н 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенола в DMSO-d6
Об этом говорит тот факт, что, во-первых, метильная группа дает 2 сигнала разной интенсивности: в более сильном поле, когда она расположена в антиположении к оксимному гидроксилу (δ 2,37 м.д.) и в более слабом, когда расположена в син-положении (δ 2,49 м.д.) из-за дезэкранирования протонов атомом кислорода оксимной группы. Интенсивность сигнала антиметильной группы выше, вероятно, из-за стабилизации такой формы за счет взаимодействия гидроксила оксимной группы и пиридинового цикла.
Во-вторых, оба сигнала протонов алкильных групп сложноэфирного заместителя (два синглета в области δ 3,45 м.д. δ 3,83 м.д.) «двоятся», что видно при изменении масштаба по оси химических сдвигов. Это хорошо объясняется расположением в син- либо антиположении по отношению к гидроксильной группе оксима.
В-третьих, в спектре появляется сигнал одиночного протона в области очень слабого поля (δ 11,97 м.д.), что характерно для «кислого» протона оксимной группы.
Экспериментальная часть
Для выделения свободных нитрозофенолов подкисляли соли 2,6-ди(алкоксикарбонил)-3-метил-5-пиридин-2(3,4)-ил-4-нитрозофенолов 1н HCl при перемешивании до pH ≈ 6,5. Из реакционной массы отфильтровывали на фильтре Шотта светло-бежевые кристаллы, которые промывали водой для удаления KCl, затем перекристаллизовывали из этанола.
Для определения константы мономеризации методом ЯМР1Н, проводили две независимые серии опытов с навеской соответствующей концентрации 0,125 моль/л с последующим разбавлением до концентрации 0,002 моль/л с уменьшением концентрации вдвое на каждый шаг.
Выводы
1. В ходе проведенного исследования установлено, что соли полностью замещенных нитрозофенолов с пиридиновым заместителем существуют в нитрозоформе как в твердом состоянии, так и в водном растворе.
2. Свободные нитрозофенолы с пиридиновым заместителем в твердом виде димеризованы. В растворе хлороформа между димером и мономером устанавливается равновесие, в котором преобладает димер и лишь при сильном разбавлении появляется мономерная форма; константа мономеризации составляет 0,11 ± 0,02.
3. В диметилсульфоксиде перзамещенные нитрозофенолы существуют исключительно в форме хиноноксимного таутомера, поэтому димеризация молекул невозможна.
Библиографическая ссылка
Кукушкин А.А., Роот Е.В., Кондрасенко А.А., Скрипальщикова А.В., Субоч Г.А., Товбис М.С. СПЕКТРОСКОПИЧЕСКОЕ ИЗУЧЕНИЕ СТРОЕНИЯ, ТАУТОМЕРИИ И ДИМЕРИЗАЦИИ НОВЫХ ПЕРЗАМЕЩЕННЫХ НИТРОЗОФЕНОЛОВ С ПИРИДИНОВЫМИ ЗАМЕСТИТЕЛЯМИ // Успехи современного естествознания. 2016. № 4. С. 32-37;URL: https://natural-sciences.ru/ru/article/view?id=35857 (дата обращения: 01.03.2026).



