Для получения практически важных гетероциклических соединений в современном органическом синтезе широко используются реакции циклофункционализации [8, 9]. Для синтеза сераорганических гетероциклических соединений используются реакции гетероциклизации c участием серасодержащих реагентов [7, 8]. Использование дихлорида серы в синтезе гетероциклических соединений в большинстве случаев основано на способности этого реагента присоединяться к двойным связям диеновых соединений [1]. Неорганические галогениды серы и селена в реакциях циклофункционализации практически не использовались [3].
Ранее нами показана возможность проведения реакций гетероциклизации и циклофункционализации с дигалогенидами селенами – новыми электрофильными реагентами, которые в последнее время стали широко применяться в синтезе селенорганических соединений [2–6]. Впервые осуществлена реакция дибромида селена с 2-аллилфенолом, которая приводит к ранее неизвестному бис(2,3-дигидро-1-бензофуран-2-илметил)селениду [3]. Реакция дибромида селена с 2-аллилфенолом проводится путем смешивания реагентов при температуре – 20 °С в растворе четыреххлористого углерода с последующим кипячением реакционной массы. Выход бис(2,3-дигидро-1-бензофуран-2-илметил)селенида составляет 95 % [3].
Сведения о реакции дихлорида серы с 6-аллил-3-метилфенолом в литературе отсутствуют. Нами впервые осуществлена реакция дихлорида серы с 6-аллил-3-метилфенолом с целью разработки эффективного метода синтеза бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфида.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400.13, и 100.61 МГц, соответственно) в CDCl3, внутренний стандарт – ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфид (1). Охлажденный до – 20 °С раствор 0,185 г (1,79 ммоль) дихлорида серы в 10 мл хлористого метилена добавили по каплям к охлажденному до – 20 °С раствору 0,53 г (3,5 ммоль) 6-аллил-3-метилфенола в 10 мл хлористого метилена. Смесь перемешивали 5 ч при комнатной температуре, добавили 0,14 г (3,5 ммоль) предварительно растертого в порошок гидроксида натрия и оставили перемешиваться на ночь (16 ч). Смесь фильтровали, из фильтрата отогнали растворитель. Продукт выдел или колоночной хроматографией на силикагеле (элюент: хлороформ/гексан 1: 1). Получили 0,457 г (выход 80 %) бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил) сульфида, бесцветную вязкую жидкость.
Спектр ЯМР 1Н, δ, м. д. (CDCl3): 2.25 с (6Н, CH3), 2.86-3.05 м (6H, CH2, CH2S), 3.27 м (2H, CH2), 4.95 м (2H, OCH), 6.59-6.61 м (2H, C6H3), 6.65-6.67 м (2H, C6H3), 6.99-7.03 м (2H, C6H3).
Спектр ЯМР 13С, δ, м. д. (CDCl3): 21,49 (CH3), 34,00 (SCH2), 37,87 (CH2), 82,08 (OCH), 110,21 (C6H4), 121,29 (C6H4), 123,12 (C6H4), 125,21(C6H4), 138,23 (C6H4), 159,40 (CO, C6H4).
Найдено, %: С 73,82; Н 6,96; S 10,08, C20H22O2S, Вычислено, %: С 73,58; Н 6,79; S 9,82.
Бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфоксид (2). К смеси 0,185 г (0,9 ммоль) периодата натрия и 10 мл метанола, охлажденной до 0 °С, добавили раствор 0,2 г (0,61 ммоль) бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфида в 10 мл метанола, охлажденный до 0 °С. Смесь перемешивали 1 ч при 0 °С и 16 ч при комнатной температуре. Смесь отфильтровали от осадка, из фильтрата отогнали растворитель, остаток сушили в вакууме. Получили 0,199 г (выход 95 %) бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфоксида в виде светло-желтого масла.
Спектр ЯМР 1Н, δ, м. д. (CDCl3): 2,23 с (6Н, CH3), 2,93-3,23 м (6H, CH2, CH2S), 3,30-3,40 м (2H, CH2S), 5,28 м (2H, OCH), 6,56-6,72 м (4H, C6H3), 7,01 м (2H, C6H3).
Спектр ЯМР 13С, δ, м. д. (CDCl3): 21,57 (CH3), 34,76 (CH2), 57,22 (SCH2), 76,57 (OCH), 110,48 (C6H4), 122,10 (C6H4), 124,72 (C6H4), 128,37(C6H4), 138,58 (C6H4), 158,42 (CO, C6H4).
Найдено, %: С 69,86; Н 6,65; S 8,96, C20H22O3S, Вычислено, %: С 70,15; Н 6,48; S 9,36.
Результаты исследования и их обсуждение
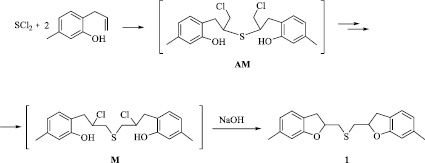
Нами систематически изучена реакция дихлорида серы с 6-аллил-3-метилфенолом с целью разработки эффективного метода синтеза бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфида (1). Проведение реакции в условиях, аналогичных реакции дибромида селена с 2-аллилфенолом [3], привело к целевому продукту, но с низким выходом. Установлено, что для селективного образования продукта с высоким выходом требуется добавление в реакционную смесь таких оснований, как NaOH, K2CO3, Na2CO3 или NaHCO3. Следует отметить, что эффект анхимерного содействия атома селена в 2-галогенэтилхалькогенидах значительно превышает аналогичный эффект атома серы, и нуклеофильное замещение галогена в 2-галогенэтилхалькогенидах значительно быстрее протекает в случае атома селена [5]. Также установлено, что образование продукта более эффективно протекает в среде хлороформа – более полярного растворителя по сравнению с четыреххлористым углеродом.
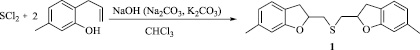
Установлено, что для достижения высокого выхода продукта 1 (80 %) необходимо смешивать реагенты при низкой температуре (– 20 °С) и после перемешивания реакционной массы при комнатной температуре добавлять основание (NaOH, K2CO3, Na2CO3 или NaHCO3).
Известно, что реакции присоединения дигалогенидов серы и селена к алкенам, как правило, первоначально приводят к образованию кинетического продукта присоединения против правила Марковникова, который затем превращается в термодинамически более устойчивый продукт присоединения по правилу Марковникова [5], причем изомеризация легче протекает в более полярных растворителях. Можно предполагать, что аналогичным образом протекает и реакция ди- хлорида серы с 2-аллилфенолом, в которой для образования сульфида 1 требуется изомеризация кинетического продукта присоединения против правила Марковникова (АМ) в термодинамически более устойчивый продукт присоединения по правилу Марковникова (М), и изомеризация быстрее идет в хлороформе, чем в четыреххлористом углероде. После добавления в реакционную смесь основания (NaOH, K2CO3, Na2CO3 или NaHCO3) в продукте присоединения по правилу Марковникова (М) реализуется реакция нуклеофильного замещения хлора гидроксильной группой, которая приводит к сульфиду 1.
В случае реакции дибромида селена с 2-аллилфенолом изомеризация легко протекает в СС14 за счет высокого анхимерного эффекта атома селена, однако в синтезе сульфида 1 требуется более полярный растворитель. Необходимость использования основания для получения сульфида 1 объясняется не только меньшим эффектом анхимерного содействия атома серы по сравнению с селеном, но тем, что нуклеофильное замещение атома хлора протекает медленнее, чем атома брома.
На основе реакции окисления сульфида 1 периодатом натрия в метаноле разработан эффективный способ получения ранее неизвестного бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфоксида (2) с выходом 95 %.
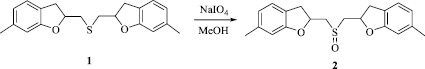
Строение соединений 1 и 2 доказано методом ЯМР 1Н и 13С и подтверждено данными элементного анализа. Сигнал группы CH2S в спектре ЯМР 13С бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфоксида (57,22 м. д.) значительно смещен в область слабого поля по отношению к сигналу группы CH2S в спектре ЯМР 13С бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфида (34,00 м. д.), что характерно для спектров ЯМР 13С органических сульфоксидов.
Следует отметить, что ряд соединений, содержащий фурановый фрагмент, обладает высокой биологической активностью [10]. Можно предполагать, что полученные новые соединения 1 и 2, содержащие дигидрофурановую, сульфидную и сульфоксидную функции, также могут проявить биологическую активность.
Выводы
Таким образом, разработаны удобные эффективные региоселективные способы получения ранее неизвестных бис(6-метил-2,3-дигидро-1-бензофуран-2-илметил)сульфида и -сульфоксида, которые делают эти соединения легкодоступными и открывают возможности их использования в органическом синтезе. Полученные соединения являются перспективными полупродуктами для органического синтеза и потенциально биологически активными веществами.
Работа выполнена в рамках проекта Российского научного фонда (№ 14-13-01085). Основные результаты получены с использованием материально-технической базы Байкальского аналитического центра коллективного пользования СО РАН.



