Идеи создания композиций различных синтетических полимеров появились в 70-х годах XX века. На данный момент крупные в области производства полимерной продукции фирмы выдвинули свои версии биоразлагаемых материалов. Немецкая компания Bayer представила новый биоразлагаемый полиэфирамид. Полимер имеет полукристаллическую структуру и производится литьем под давлением или экструдируется на традиционном оборудовании. Сырьем для его производства является гексамителен диамин, бутандиол и адипиновая кислота. Получаемая пленка обладает степенью прозрачности, ранжируемой от полупрозрачной до прозрачной. Процесс биоразложения упаковки происходит в течение 60-ти дней при контакте с бактериями и грибками [12]. Итальянская фирма Novamont SpA разработала четыре композиции материала марки Mater Bi, нетоксичного полиацеталя на основе крахмала. Английская компания Environmental Polymers Group (EPG) работает над специальными сортами поливинилового спирта, который способен к биоразложению в горячей и холодной воде [4].
Разработка новых технологических процессов на основе биокатализаторов, иммобилизованных в структуры различной природы, открывает пути не только получения новых материалов, но и способствует совершенствованию уже имеющихся. Сохранение активности и стабильности биологических веществ (в частности, ферментов) во времени связано с необходимостью создания биоспецифической основы и разработкой методов включения биологических субстанций в структуру материала-носителя.
Известен метод включения фермента в гель или микрокапсулы, ограниченные от раствора полупроницаемой (непроницаемой для макромолекул субстрата) мембраной, суть которого состоит в том, что молекулы фермента включаются в трехмерную сетку из тесно переплетенных полимерных цепей, образующих гель. Дополнительный вклад в удерживание фермента в сетке геля могут вносить также ионные и водородные связи между молекулой фермента и окружающими ее полимерными цепями. Для иммобилизации ферментов в геле существуют два основных способа. При одном из них фермент помещают в водный раствор мономера, а затем проводят полимеризацию, в результате чего образуется полимерный гель с включенными в него молекулами фермента. В реакционную смесь часто добавляют также бифункциональные (содержащие в молекуле две двойные связи) сшивающие агенты, которые придают образующемуся полимеру структуру трехмерной сетки. В другом случае фермент вносят в раствор готового полимера, который затем каким-либо образом переводят в гелеобразное состояние [9].
Химические методы иммобилизации ферментов в настоящее время являются доминирующим способом получения гетерогенных биокатализаторов. При подборе условий иммобилизации препарата Т.А. Ковалевой с соавторами выявлено, что наиболее предпочтительным носителем является анионообменная смола АВ-17-2П. Оптимальным методом иммобилизации является модифицированный глутаральдегидный способ ковалентного связывания фермента с носителем, заключающийся в процессе наращивания связывающего звена между ферментом и анионитом при обработке рядом органических реагентов [7]. Согласно мнению И.В. Березина, А.А. Клёсова, по сравнению с иммобилизацией ферментов, иммобилизация клеток микроорганизмов имеет ряд преимуществ. При использовании иммобилизованных клеток отпадает необходимость выделения, очистки и иммобилизации ферментов – стадий часто наиболее дорогостоящих при осуществлении промышленного процесса. Ферменты в микроорганизмах находятся в своем естественном окружении, что повышает их термостабильность и так называемую операционную стабильность (продолжительность работы в условиях технологического процесса) [3]. Известно много примеров, когда ферменты после выделения из организма быстро теряют активность, а иногда их вообще не удается выделить в активной форме. В то же время в составе клеток микроорганизмов они сохраняют каталитические свойства достаточно долго [6].
Наиболее широко применяемыми в клинической практике являются протеолитические ферменты. Поэтому большое количество исследований посвящено получению их иммобилизованных производных. Представляют интерес иммобилизованные системы, в которых биокаталитическое действующее начало (препарат фермента трипсина) включено в матрицу макропористого криогеля поливинилового спирта (ПВС) в составе частиц дисперсного наполнителя, распределенных по всему объему носителя, что позволяет значительно повысить содержание фермента в иммобилизованном биокатализаторе [10]. Первый тип подобных наполнителей – препараты ферментов, сшитых с полимером в растворе бифункциональным сшивающим агентом, содержащим необходимые химические группировки. Второй тип наполнителя разработан зарубежными учеными и представляет собой поперечно-сшитые ферментные кристаллы (ПСФК), или поперечно-сшитые ферменты (ПСФ), или поперечно-сшитые ферментные агрегаты (ПСФА). Такие препараты получают обработкой бифункциональными сшивающими агентами кристаллов фермента, раствора фермента или его агрегатов соответственно [13]. Третий тип наполнителя представляет собой какой-либо мелкодисперсный носитель с присоединенным ферментом; далее частицы подобного иммобилизованного препарата могут быть включены в матрицу криогеля ПВС.
Т.Н. Шеховцовой с соавторами обобщены результаты цикла исследований, посвященных разработке ферментативных методов определения биологически активных соединений – ингибиторов, активаторов и субстратов растворимых и иммобилизованных ферментов классов оксидоредуктаз (пероксидаз, алкогольдегидрогеназ) и гидролаз (щелочных и кислых фосфатаз), выделенных из различных источников. Обсуждены предложенные авторами новые оригинальные подходы к направленному повышению чувствительности, селективности и экспрессности методов. Приведены многочисленные примеры использования разработанных ферментативных методик в анализе широкого круга объектов [11].
Поэтому перед авторами данной работы стояла задача разработки новых универсальных и совершенствования уже существующих биоактивных материалов с прогнозируемым сроком сохранения активности с использованием фотометрического метода анализа, пролонгируемым эффектом и способностью к биодеструкции.
Материалы и методы исследования
Объектами исследования служили композиции, содержащие в качестве основы возобновляемый природный биоразлагаемый материал полисахарид – метилцеллюлозу. Для получения пластичной пленки в композиции вводили пластификатор (глицерин). В качестве дополнительных компонентов, для придания твердости пленочному покрытию, использовали природный белковый комплекс желатина.
Способ получения композиций, подвергающихся биодеструкции, представлен в работе авторов С.С. Аванесян, Е.В. Волосовой и др. [1]. Получали 3–5 %-ный раствор метилцеллюлозы внесением ее в горячую воду, выдерживали 1,5–2 часа. Затем в полученный коллоидный раствор вносили желатин (3–5 %-ный раствор) и пластификатор глицерин (0,5–1 % от общей массы) для придания гибкости и интенсивно перемешивали. Полученную композицию наносили на гладкую стеклянную поверхность желаемой формы толщиной и оставляли на воздухе при температуре 20–22 °С на 2–3 суток до полного высыхания [5].
Для иммобилизаций был использован фермент трипсин, представляющий собой протеиназы, гидролизирующие пептидные связи, отличающиеся друг от друга по месту действия на полипептидную цепь белка. Данные протеиназы относятся к малоспецифическим протеиназам или к ферментам тотального протеолиза. Благодаря своим свойствам трипсин важен не только в процессе пищеварения, но и в уничтожении чужеродного, в том числе и атипического, белкового материала.
Для иммобилизации трипсина в структуру пленочного материала была разработана следующая методика. В приготовленный коллоидный раствор метилцеллюлозы вводили раствор фермента в воде объемом 1 мл – 10 мг кристаллического трипсина в 100 мл 0,005 М раствора HCl. Затем формовали биопленки.
Количественное определение белка проводили методом O. Warburg и W. Christian (1941) сравнением поглощения белков при 280 и 260 нм на спектрофотометре СФ-46 ((ГОСТ 15150-69), ООО «Уралмеханобр» (Россия)) [8].
Определение протеолитической активности трипсина основано на количественном определении тирозина в продуктах расщепления казеина. Для этого готовили 1 %-ный раствор казеина в 0,05 М ацетате натрия. К 1 мл полученного раствора казеина добавляли 1,5 мл фосфатного буфера (pH = 8,0), 0,5 мл раствора трипсина (10 мг трипсина в 100 мл 0,005М HCl). Пробу термостатировали при 37 °С в течение 20 минут. Затем вносили 3 мл 10 % трихлоруксусной кислоты (ТХУ). В качестве контроля использовали пробу, аналогичную опытной, но ТХУ добавляли предварительно (до термостатирования). Осадок отделяли фильтрованием через бумажный фильтр. Оптическую плотность замеряли в пробе против контроля в кювете с толщиной слоя 1 см при длине волны 260 и 280 нм. Затем, исходя из оптической плотности, определяли количество тирозина в растворе и рассчитывали удельную активность фермента [2].
Результаты исследования и их обсуждение
Анализ физико-химических свойств полученных пленок предполагал исследование спектров поглощения в УФ-области. Для определения удельной активности иммобилизованного фермента трипсина была разработана методика, где в качестве субстрата использовали казеин. 0,07 г пленки, содержащей 1,63 мг фермента, растворяли в 20 мл фосфатного буферного раствора pH = 8,15. Для определения активности брали аликвоту раствора пленки объемом от 0,01 до 1 мл. Удельную активность фермента трипсина определяли спектрофотометрически. Однопроцентный раствор казеина готовили растворением навески белка в 0,05 М растворе ацетата натрия. К 1 мл полученного раствора казеина добавляли 1,5 мл фосфатного буферного раствора (pH = 8,15); 0,5 мл раствора трипсина (10 мг трипсина в 100 мл 0,005 М HCl). Пробу термостатировали при температуре 37 °С в течение 20 минут. Затем вносили 3 мл 10 % раствора трихлоруксусной кислоты (ТХУ). В качестве контроля использовали пробу, аналогичную опытной, но ТХУ добавляли до термостатирования. Осадок отделяли фильтрованием через бумажный фильтр. Оптическую плотность в пробе измеряли против контроля в кювете с толщиной слоя 1 см при длине волны 260 и 280 нм. По количеству тирозина в растворе рассчитывали удельную активность фермента.
Калибровочный график в координатах оптическая плотность ‒ количество тирозина представлен на рис. 1.
Для анализа влияния количества фермента на удельную активность растворимого и иммобилизованного трипсина проводили постановку ферментативной реакции с различным содержанием фермента в исследуемых пробах (1,0∙10–2; 2,5∙10–2 мг; 5,0∙10–2 мг; 7,5∙10–2 мг; 10∙10–2 мг) и одинаковым количеством казеина в них (1 мл 1 % казеина – 0,01 г казеина). Для анализа использовали пять экспериментальных серий препарата иммобилизованного фермента трипсина (рис. 2).
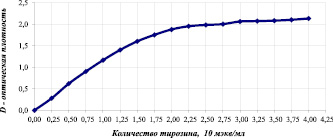
Рис. 1. Спектрофотометрическое определение тирозина в растворе
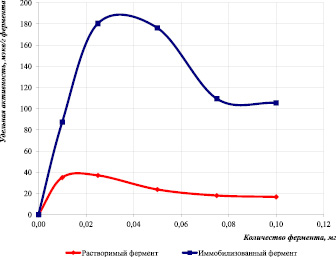
Рис. 2. Влияние количества растворимого и иммобилизованного трипсина, приходящегося на 1 мг субстрата казеина на удельную активность ферментативной реакции


а б
Рис. 3. Микрофотографии пленки с иммобилизованным ферментом трипсином: а – увеличение 20Х; б – увеличение 50Х
Анализ полученных данных позволил сделать вывод, что максимальная активность наблюдалась в том случае, когда на 1 мг субстрата казеина приходилось 0,025 мг трипсина. При этом значение удельной активности растворимого фермента составило 37 мэкв/г, иммобилизованного – 180,4 мэкв/г.
С помощью микроскопа марки RenishawInvia были сделаны микро-фотографии пленки с иммобилизованным ферментом (рис. 3, а, б).
Биоразлагаемые полимерные материалы с иммобилизованным ферментом отличаются гидрофильностью, эластичностью, прозрачностью и способностью к деградации путем гидролиза основных связей макромолекул основы при взаимодействии с физиологической средой.
Выводы
В результате проведенных исследований получены биодеградируемые полимерные материалы на основе высокомолекулярного природного полисахарида метилцеллюлозы, белкового комплекса желатина и пластификатора – глицерина. Проведена иммобилизация трипсина в пленочные материалы, спектрофотометрически определено, что трипсин, иммобилизованный в пленки, проявлял наибольшую удельную активность – 171,5 мэкв/г при рН среды – 8,15 и температуре – 37 °С, время постановки ферментативной реакции – 20 минут. Определено, что оптимальное массовое соотношение компонентов в системе субстрат-фермент при постановке ферментативной реакции следующее: 1 мг казеина на 0,025 мг фермента (40:1), активностью, проявляющейся к концу эксперимента. Включение в состав биоразлагаемых полимерных материалов биологически активных веществ, в частности различных ферментов, обладающих определенным набором свойств, делает возможным расширить спектр представленных на рынке ранозаживляющих материалов.



