Вольфрам, являясь наиболее тугоплавким металлом, имеет высокие показатели прочности и самый низкий среди металлов коэффициент сжимаемости. Сплавы вольфрама относятся к материалам с высокими эксплуатационными характеристиками (тугоплавкость, жаропрочность, твердость, конкурентоспособность при высоких температурах по отношению к другим материалам) и представляют интерес для многих стратегически важных производств.
Анодное растворение металлов широко применяется в современных технологиях. При формообразовании изделий из сплавов вольфрама, трудно обрабатываемых механически, основным методом является электрохимическая размерная обработка, определение оптимальных режимов которой требует проведения экспериментальных исследований [5, 8, 11].
Экспериментальные исследования выявляют влияние потенциала конденсированной фазы, рН, состава, температуры, скорости перемешивания электролита и некоторых других факторов на характер процессов и их вольт-амперные характеристики. Электрохимические процессы в своём большинстве многостадийны, возможность их протекания определяется термодинамическими и кинетическими характеристиками. Электрохимическая активность вольфрама и его сплавов является специфичной и определяется не в последнюю очередь исходным состоянием обрабатываемой поверхности, свойства которой могут меняться в достаточно широком диапазоне [1]. В этом случае получение экспериментальных данных является отдельной задачей, решение которой позволяет определить оптимальные характеристики анодного процесса.
Материалы и методы исследования
В работе изучалось влияние состояния поверхностной структуры вольфрама на характер анодного растворения.
В качестве исследуемых материалов применялись образцы вольфрама, полученные разными методами, с разной исходной микроструктурой поверхности (рис. 1), – технический прутковый вольфрам (99,99 %) и вольфрам, полученный из газовой фазы восстановлением гексафторида водородом по реакции
WF6 + 3Н2 = W + 6НF. (1)


а) б)
Рис. 1. Исходные микроструктуры поверхности образцов: а) пруткового вольфрама; б) вольфрама, полученного восстановлением гексафторида из газовой фазы
В качестве электролитов применялись водные растворы NаОН разной концентрации.
Измерение электродных потенциалов и регистрация анодных кривых проводились при Т = 298 К с использованием потенциостата П-5847М. Кривые записывались с помощью двухкоординатного потенциометра КСП-4 в потенциодинамическом режиме со скоростями развертки потенциала 80 мВ/с и 40 мВ/с; интервал потенциостатирования составлял 4 В.
В качестве рабочих электродов применялись образцы вольфрама с изолированными боковыми и рабочей торцевой поверхностью площадью 0,6–0,8 см2. Перед измерениями рабочая поверхность шлифовалась, полировалась, обезжиривалась и промывалась в бидистиллате.
Электроды помещались в электрохимическую ячейку из молибденового стекла с разделенными анодным и катодным пространствами. В качестве катода использовался платиновый электрод, в качестве электрода сравнения – насыщенный хлоридсеребряный. Значения потенциалов пересчитывались по отношению к нормальному водородному электроду.
Для оценки состояния поверхности электродов после анодной поляризации использовался профилограф-профилометр модели 201.
Результаты исследования и их обсуждение
Приводимые в литературных источниках значения стационарных потенциалов вольфрама в водном растворе 1М NаОН варьируются от –315 мВ до –420 мВ, что может быть связано с различиями в состоянии поверхности электрода и степени ее воспроизводимости при подготовке к измерениям [7, 10, 12].
С момента погружения исследованных образцов в растворы щелочи наблюдается незначительный сдвиг стационарных потенциалов в сторону менее отрицательных величин. Сравнительное время установления постоянных значений Ест. в растворах разной концентрации отличается несущественно. С повышением концентрации щелочи Ест смещаются в область отрицательных значений (табл. 1, 2).
Таблица 1
Зависимость Ест пруткового вольфрама от концентрации NаОН
|
№ п/п |
С, моль/л |
Ест, мВ |
|
1 |
10 М |
– 540 |
|
2 |
5 М |
–490 |
|
3 |
1 М |
–410 |
Таблица 2
Зависимость Ест гексафторидного вольфрама от концентрации NаОН
|
№ п/п |
С, моль/л |
Ест, мВ |
|
1 |
10 М |
–570 |
|
2 |
5 М |
–540 |
|
3 |
1 М |
–520 |
При анодной поляризации вольфрама непосредственный переход ион-атомов из металлической решетки в раствор в виде катионов не происходит, ионизация осуществляется через образование поверхностных оксидных пленок.
Образование оксидов происходит за счет окисления вольфрама кислородом в составе гидроксид-ионов, промежуточным продуктом является WO3
W + 6OH– = WO3 + 3H2O + 6е (2)
Высшие оксиды вольфрама частично химически растворяются в щелочи с подкислением прианодного пространства
WО3 + 2NаОН = Nа2WО4 + Н2О, (3)
образующиеся вольфраматы являются устойчивыми при рН = 8 и выше.
В обобщенном виде анодное растворение вольфрама в щелочи можно представить как
W + 8ОН– = WO42– + 4H2O + 6е. (4)
В процессе анодной поляризации на активных участках анода, роль которых выполняют границы зерен, поверхностные дефекты, формируется неравномерный оксидный слой (рис. 2).
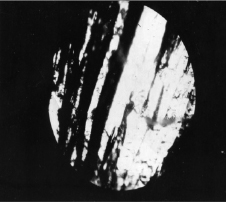
Рис. 2. Микрофотография поверхности пруткового вольфрама в процессе анодного растворения при фиксированном потенциале
В силу поливалентности вольфрама, исходя из электронного строения, термодинамически вероятно его окисление через образование оксидов промежуточных валентностей [3]. Уточнение о составе образующихся оксидов (WО2,W2O5,WО3) возможно при сопоставлении термодинамических значений редокс-потенциалов E со значениями потенциалов на участках экспериментальной анодной кривой.
Некоторым из возможных равновесий вольфрама [4, 6, 9] соответствуют, с учетом влияния рН среды (диаграмма Пурбэ), значения E:
2WO2 + H2O = W2O5 + 2H+ + 2e, E = –0,031 – 0,0591 рН; (5)
W2O5 + H2O = 2WO3 + 2H+ + 2e, E = –0,029 – 0,0591 рН; (6)
W + 4H2O = WO42– + 8H+ + 6e, E = 0,049 – 0,0788 рН + 0,0098 log [WO42–]; (7)
WO3 + H2O = WO42– + 2H+, log [WO42–] = –14,05 + 2 рН; (8)
WO2 + 2H2O = WO42– + 4H+ + 2е, E = 0,386 – 0,1182 рН + 0,0295 log [WO42–]; (9)
W2O5 + 3H2O = 2WO42– + 6H+ + 2е, E = 0,801 – 0,1773 рН + 0,0591 log [WO42–]. (10)
Результаты сравнения потенциалов (рис. 3, кривая 3) с термодинамически рассчитанными показывают, что при E > – 0,13 В возможно образование оксида WO
W + H2O = WO + 2H+ + 2e. (11)
Реакция образования оксида WO2
W + 4OH– = WO2 + 2H2O + 4e (12)
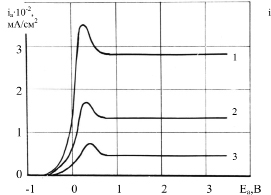
Рис. 3. Анодные потенциодинамические кривые (80 мВ/с) для пруткового вольфрама в водных растворах NaOH: 1 – 10 М NaOH; 2 – 5 М NaOH; 3 – 1 М NaOH
малореализуема, расчетное значение потенциала E = – 0,982 В значительно отрицательнее, чем значение Ест. пруткового вольфрама в однонормальной щелочи. Однако в работе [2] отмечается, что в водном растворе щелочи вблизи стационарного потенциала на поверхности вольфрама имеется полупроводниковый оксид WO2 с избытком катионных вакансий и проводимостью р-типа. Анодная поляризация способствует переносу вольфрама из объема металла в поверхностный слой и заполнению катионных вакансий; при потенциале пассивации формирующаяся пленка проходит через бездефектный эквимолекулярный состав. В пассивной области формируется нестехиометрический оксид WO3 с избыточной концентрацией анионных вакансий, являющийся полупроводником n-типа.
На потенциодинамических анодных кривых, полученных для пруткового вольфрама при разных концентрациях щелочи (скорость развертки 80 мВ/с), отмечаются области активного растворения, пассивации и глянцевания (рис. 3). В интервале потенциалов от стационарного до +0,35В (рис. 3, кривая. 3) происходит рост анодного тока, при дальнейшем облагораживании потенциала активность образца снижается за счет уменьшения активных участков поверхности по мере образования оксидной пленки. В результате электрод частично пассивируется; величина плотности тока, рассчитанная исходя из активной поверхности вольфрамового электрода, оказывается меньше истинной.
Уменьшение скорости развертки потенциала до 40 мВ/с не меняет характера анодных кривых. При этом высота пика максимального тока снижается примерно на 15 мА (с 75 мА до 60 мА) при незначительном смещении потенциала в положительную сторону. Наблюдаемые явления связаны с облегчением условий для формирования пассивирующей пленки и сокращения площади активных участков поверхности.
При достижении потенциала пассивации устанавливается практически постоянное значение анодного тока. Оксидная пленка препятствует дальнейшему окислению вольфрама, не является полностью пассивирующей и частично химически растворяется в щелочи. В данном случае характер разрушения оксидной пленки приводит к сглаживанию микронеровностей поверхности и созданию условий для электрохимического полирования – в результате анодной поляризации поверхность образцов становится блестящей.
При разных скоростях развертки в области высоких анодных потенциалов (в пределах интервала развертки 4 В от стационарного значения), выделение газообразного кислорода и переход вольфрама в транспассивное состояние не наблюдается.
Как видно из рис. 3, повышение концентрации щелочи активирует растворение вольфрама, что отмечается уменьшением значений стационарных потенциалов и смещением величины перенапряжения и плотности анодного тока. Максимальная электрохимическая активность проявляется в 10 М NаОН и снижается при переходе к 5 М NаОН и 1 М NаОН. При потенциале Еа = –0,35В анодный ток в 10 М NаОН примерно на 10 мА больше, чем в 5 М NаОН, и на 30 мА – чем в 1 М NаОН. С ростом поляризации электрода эта разница увеличивается и составляет при Еа = + 0,25В 180 мА и 290 мА соответственно.
На анодных кривых для фторидного вольфрама (рис. 4) также определяются участки активного растворения, пассивации, в результате поляризации наблюдается эффект глянцевания. Сравнительной особенностью кривых является их сглаживание, отсутствие выраженных пиков анодного тока в области потенциалов, предшествующих пассивации, широкие площадки предельного тока. С повышением концентрации щелочи процесс активируется, стационарные потенциалы и максимумы тока смещаются в область отрицательных значений. Наибольшая электрохимическая активность проявляется в растворе 10 М NaOH, максимум тока достигается при меньшем значении поляризации. Разница в смещении анодных потенциалов в положительную сторону при уменьшении концентрации щелочи от 10 М NаОН к 5 М NаОН и 1 М NаОН в области максимальных токов составляет около 200 мВ и 300 мВ.
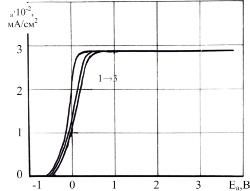
Рис. 4. Анодные потенциодинамические кривые (80 мВ/с) для фторидного вольфрама в водных растворах NaOH: 1 – 10 М NaOH; 2 – 5 М NaOH; 3 – 1 М NaOH
Для кривых характерны высокие значения предельных токов, сопоставимые со значением для кривой 1 рис. 3, электрод экранируется слоем высшего оксида WO3, образующегося по реакции (2), равновесный потенциал которой E = –0,09 В. Установившаяся величина предельного тока не зависит от концентрации щелочи, мелкозернистая направленно ориентированная поверхностная структура способствует более интенсивному и равномерному окислению поверхности.
Для оценки шероховатости поверхности анодно поляризованных образцов определялся параметр Rz. Для пруткового вольфрама значение параметра Rz составляет 0,8 мкм, для фторидного 0,54 мкм, – образование более равномерной пассивирующей пленки приводит к уменьшению шероховатости и улучшению качества электрополирования.
Выводы
На основании полученных экспериментальных данных сделаны следующие выводы. Установлен характер анодных кривых для образцов вольфрама с разной поверхностной структурой. При имеющихся различиях на кривых отмечаются области активного растворения, пассивации и глянцевания, с увеличением рН раствора анодный процесс активируется. Анодная активность образцов определяется соотношением конкурирующих процессов растворения вольфрама и образования оксидных пленок; транспортные характеристики пленки пассивирующего оксида определяют величину предельного тока и создают условия для электрополирования поверхности. Различия в поверхностной структуре образцов приводят к разным значениям параметра Rz – мелкозернистая структура фторидного вольфрама способствует более интенсивному и равномерному окислению поверхности и уменьшению ее шероховатости.
Библиографическая ссылка
Березина С.Л., Горячева В.Н., Двуличанская Н.Н., Ермолаева В.И., Слынько Л.Е. АНОДНОЕ ПОВЕДЕНИЕ ВОЛЬФРАМА С РАЗЛИЧНОЙ ПОВЕРХНОСТНОЙ СТРУКТУРОЙ В ЩЕЛОЧНОМ ЭЛЕКТРОЛИТЕ // Успехи современного естествознания. 2017. № 4. С. 7-11;URL: https://natural-sciences.ru/ru/article/view?id=36426 (дата обращения: 17.01.2026).



