В современной химии всё чаще говорят о комплексных соединениях, поскольку они обладают специфическими свойствами (например, могут являться адсорбентами или «транспортом» для ферментов), что даёт широкие возможности как практического, так и теоретического характера. КС способны образовывать как металлы, так и неметаллы. Особый интерес в настоящее время представляют комплексные соединения металлов с различными органическими лигандами. Ранее был осуществлён синтез 1,4-фенилен-бис-диантипирилметана при участии терефталевого альдегида по реакции электрофильного замещения в ароматическое кольцо гетероцикла антипирина согласно схеме 1. Структура продукта синтеза была установлена методами масс-спектрометрии и ЯМР 1H, 13C-спектроскопии [1]. Диантипирилметан и его производные являются одними из примеров, широко применяемых в аналитической химии комплексообразователей [2].
Так, диантипирилметан и его алифатические производные применяют в роли сорбентов, катализаторов и экстрагентов, в фотометрическом и гравиметрическом анализах [3, 4]. Эти данные позволяют предполагать высокую комплексообразующую способность нового, полученного нами производного – 1,4-фенилен-бис-диантипирилметана. В связи с этим целью настоящей работы явилось исследование возможности взаимодействия 1,4-фенилен-бис-диантипирилметана с катионами d-металлов путем определения стабильности гипотетических комплексов с помощью квантово-химических расчетов.
Материалы и методы исследования
Оптимизацию геометрических параметров комплексов с катионами металлов производили в приближении HF/6-311G, на функциях ограниченного метода Хартри – Фока с открытой оболочкой. Для начала были построены и рассчитаны модели в газовой фазе, а затем с учетом влияния растворителя (этилового спирта), которое учитывали с помощью континуальной модели PCM-C.
Результаты исследования и их обсуждение
Первоначальной и самой важной задачей являлось правильное построение молекулы и её оптимизация. Пространственное расположение фрагментов органической молекулы в некоторых случаях может оказывать сильное воздействие на распределение электронной плотности внутри структуры [3–5].
На рис. 1 приведена оптимизированная квантово-химическая модель 1,4-фенилен-бис-диантипирилметана, на основании которой далее производили расчет взаимодействия с катионами металлов. Предполагая, что «центральный» цикл не будет оказывать существенного влияния на комплексообразование (из-за размеров самой молекулы), моделирование реакции с металлами осуществляли только при участии электронно-акцепторной части молекулы – диантипирилметанового фрагмента, приведенного на рис. 2 [3, 6].
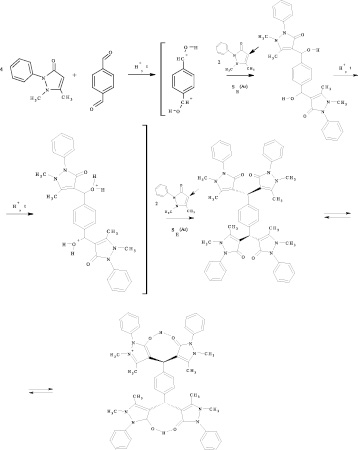
Реакция электрофильного замещения в гетероциклическое кольцо антипириналигандами
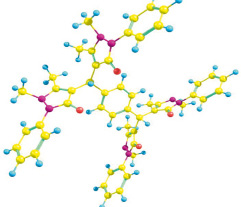
Рис. 1. Геометрическое строение оптимизированной структуры ароматической модификации 1,4-фенилен-бис-диантипирилметана
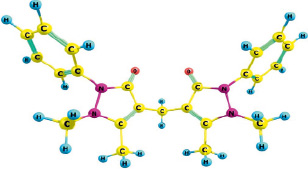
Рис. 2. Геометрическое строение диантипилиметанового фрагмента 1,4-фенилен-бис-диантипирилметана
Для определения реакционного центра органической молекулы методом Хартри – Фока с открытой оболочкой HF/6-311G рассчитали распределение электронной плотности и электростатического потенциала (рис. 3) [6, 7]. Далее, к оптимизированному фрагменту последовательно присоединяли катионы переходных d-металлов. Устойчивость комплексов определяли по разности энергий образования комплексов и исходного фрагмента молекулы. Чем большие значения ΔE соответствуют комплексу с металлом, тем сильнее связывается металл с 1,4-фенилен-бис-диантипирилметаном.
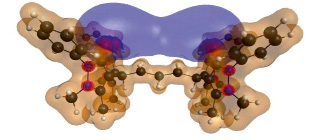
Рис. 3. 3D модель распределения электронной плотности и электростатического потенциала. Синим цветом обозначена локализация отрицательного электростатического потенциала, коричневым – положительного заряда, красной «сеткой» отмечена электронная плотность
Таким образом, наибольшая электронная плотность сконцентрирована на атомах азота и кислорода, но при этом отрицательный потенциал локализован на кислородных центрах. Следовательно, реакционным центром молекулы при взаимодействии с катионами металлов или электроноакцепторными частицами следует ожидать атомы кислорода. Причем, учитывая локализацию электростатического потенциала, катионы металлов будут устремляться в молекулярное пространство между карбонильными группами гетероциклов, ориентированных в одной полуплоскости [7, 8]. Что касается азота, то даже при наличии донорных групп и участия в мезомерном эффекте (положительный МФ), реакции присоединения с его участием произойти не могут из-за стерического фактора. Остальная же часть молекулы покрыта положительным электростатическим потенциалом, что определяет возможность хорошего сольватирования молекулами полярных протонных и апротонных растворителей.
Согласно результатам расчета, представленным в таблице, можно сделать вывод, что в целом все значения ΔE для изученных металлов достаточно велики, что определяет высокую вероятность формирования устойчивых комплексов катионов изученных металлов с 1,4-фенилен-бис-диантипирилметаном [9, 10]. Однако, наиболее стабильное соединение с 1,4-фенилен-бис-диантипирилметаном формирует катион Cu2+(рис. 4). Следовательно, из растворов сложного состава с наибольшим коэффициентом распределения должна извлекаться медь. Лиотропный ряд ионов металлов согласно значениям ΔE выглядит следующим образом: Cu2+>Zn2+>Ni2+>Co2+>Ge4+(в сравнении с p-элементом – германием). Зависимости устойчивости комплексов от ионных радиусов элементов не наблюдается, так как для всех катионов металлов характерно примерно одинаковое расстояние до реакционного центра молекулы [11, 12]. Очевидно, подобное распределение связано с увеличением плотности сольватной оболочки, снижающей жесткость ионов металлов – кислот Льюиса, что, согласно теории жестких и мягких кислот и оснований Льюиса – Пирсона, уменьшает вероятность образования стабильного продукта с кислород-центрированным жестким основанием [11, 13].
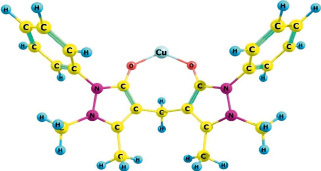
Рис. 4. Геометрическое строение оптимизируемого с металлами фрагмента
Энергии образования комплексов 1,4-фенилен-бис-диантипирилметана с катионами металлов
|
Металл |
Ge Z = 32 |
Co Z = 27 |
Ni Z = 28 |
Zn Z = 30 |
Cu Z = 29 |
|
Ионный радиус, нм |
0,073 |
0,074 |
0,069 |
0,074 |
0,073 |
|
E0, хартри |
–3310,689 |
–2620,079 |
–2744,902 |
–3014,482 |
–2876,295 |
|
ΔE, кДж/моль |
–531,891 |
–595,462 |
–619,646 |
–681,167 |
–716,274 |
Выводы
1. Методом Хартри – Фока с открытой оболочкой HF/6-311G в программе Firefly (ранее известна как PC GAMESS) смоделировано распределение электронной плотности и установлены электронодонорные реакционные центры молекулы 1,4-фенилен-бис-диантипирилметана.
2. Определено, что реакции присоединения с участием атомов азота пиразольных колец маловероятны из-за стерического фактора, и катионы металлов будут устремляться к атомам кислорода в молекулярное пространство между карбонильными группами гетероциклов, ориентированных в одной полуплоскости.
3. Рассчитаны энергии образования комплексов 1,4-фенилен-бис-диантипирилметана с катионами d-металлов, на основании которых составлен ряд устойчивости комплексов (Cu2+>Zn2+>Ni2+>Co2+>Ge4+).
Библиографическая ссылка
Абрамова В.В., Пешков С.А., Строганова Е.А., Дубских В.А., Чигринева Н.А. ВОЗМОЖНОСТЬ ОБРАЗОВАНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 1,4-ФЕНИЛЕН-БИС-ДИАНТИПИРИЛМЕТАНА С КАТИОНАМИ НЕКОТОРЫХ D-МЕТАЛЛОВ // Успехи современного естествознания. 2018. № 4. С. 7-11;URL: https://natural-sciences.ru/ru/article/view?id=36717 (дата обращения: 17.11.2025).



