Термодинамические константы диссоциации протонированного основания определяются следующими соотношениями [11]:
![]() (1)
(1)
В уравнении (1) ![]() - активность ионов лиония, то есть сольватированного иона водорода, в последующем примем обозначение а(лиония), в любой точке потенциометрического титрования;
- активность ионов лиония, то есть сольватированного иона водорода, в последующем примем обозначение а(лиония), в любой точке потенциометрического титрования; ![]() - равновесные концентрации нейтрального и протонированного трехкислотного основания в процессе титрования сильной кислотой;
- равновесные концентрации нейтрального и протонированного трехкислотного основания в процессе титрования сильной кислотой; ![]() - коэффициенты активности нейтральной и протонированных форм полиоснования.
- коэффициенты активности нейтральной и протонированных форм полиоснования.
Как отмечалось ранее [10], известные методы оценок ионной силы при кислотно-основном равновесии [2,4,13] основаны на использовании концентрации первой ионизированной частицы, например, [ВH+] для двухкислотного основания. Было показано [3,9,10,11], что в расчетах констант диссоциации не следует пренебрегать равновесными концентрациями остальных ионов, так как их величины в различных точках титрования сопоставимы с концентрацией первого протонированного иона, а из данных табл. 2 и рис. 1 видно, что в процессе нейтрализации концентрации последующих ионов (например, [ВH33+]) даже превышают таковые иона [ВH+].
Наиболее приемлемым способом оценки ионной силы, определяемой с учетом равновесных концентраций всех заряженных частиц, является представление кривой титрования основания в логарифмических координатах [9,10,11]. При этом равновесные концентрации всех частиц ![]() , образующихся при титровании трехкислотного основания сильной одноосновной пара-толуолсульфокислотой, могут быть определены на диаграммах -lg а(лиония) - lgC. Оценка значений коэффициентов активности f0, f1, f2, f3 проводится по более оптимальному методу Дэвиса [12]:
, образующихся при титровании трехкислотного основания сильной одноосновной пара-толуолсульфокислотой, могут быть определены на диаграммах -lg а(лиония) - lgC. Оценка значений коэффициентов активности f0, f1, f2, f3 проводится по более оптимальному методу Дэвиса [12]:
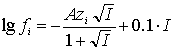 (2)
(2)
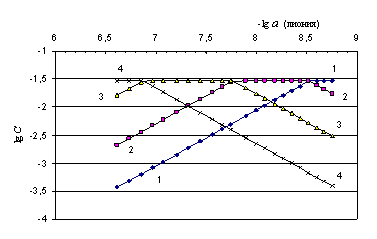
Рис. 1. Логарифмическая диаграмма процесса титрования 0.03904 н. раствора 3,4,4´-триаминодифенилоксида 0.1541 н. раствором хлорной кислоты в среде ацетона, дающая возможность определения концентраций равновесных частиц:
1-1: lg [B], 2-2: lg[BH+], 3-3: lg[BH22+], 4-4: lg[BH33+].
Измерения ЭДС и потенциометрическое титрование в среде ацетона осуществляли при 25.0 ± 0.20С на рН-метре-милливольтметре METROHM-632 (Швейцария). Растворитель очищен и обезвожен по известным методикам [5,6]. Содержание воды, определенное модифицированным методом К.Фишера [8], не превышало для ацетона ±0.01 мас.%.
В табл. 1 приведены данные измерения ЭДС цепи (I) в среде ацетона в зависимости от моляльной концентрации хлорной кислоты, а также результаты оценки степени диссоциации HClО4 и исходные величины для расчета стандартного потенциала цепи.
Таблица 1. Изменение ЭДС цепи (I) в зависимости от моляльной концентрации хлорной кислоты (m, моль HClO4/1000г ацетона) и данные для определения Е0 цепи (I)
|
m |
E, B |
α (HClO4) |
-0.0595×lg (mα) |
(m×α)0.5 |
E´ |
|
0.024375 |
0.523 |
0.926559 |
-0.097947836 |
0.150282685 |
0.620948 |
|
0.0121875 |
0.518 |
0.955441 |
-0.115065961 |
0.107909368 |
0.633066 |
|
0.0060937 |
0.514 |
0.973990 |
-0.132480572 |
0.077040285 |
0.646481 |
|
0.0030468 |
0.509 |
0.984219 |
-0.150122322 |
0.054760561 |
0.659122 |
|
0.0015234 |
0.504 |
0.990425 |
-0.167871182 |
0.038843450 |
0.671871 |
|
0.0007617 |
0.496 |
0.993475 |
-0.185703007 |
0.027508729 |
0.681703 |
Степень диссоциации хлорной кислоты может быть оценена по уравнению (3) [1,9,10,11].
![]() (3)
(3)
Величина ![]() , равная разности
, равная разности ![]() (
( ![]() ), определена по программе «mnk» (метод наименьших квадратов) по зависимости
), определена по программе «mnk» (метод наименьших квадратов) по зависимости ![]() при lg m = 0. Получена величина
при lg m = 0. Получена величина ![]() = 0.5515 с коэффициентом регрессии r = 0.9936.
= 0.5515 с коэффициентом регрессии r = 0.9936.
Значение стандартного потенциала цепи (I) определено по авторской компьютерной программе «cubic» по приближению функции ![]() при
при ![]() , где
, где ![]() .
.
![]() , r = 0.9999.
, r = 0.9999.
Таким образом, получена величина стандартного потенциала цепи (I) в среде ацетона, равная Ео = 0.7127 В. Попутно отметим, что показатель константы диссоциации хлорной кислоты в ацетоне равен: ![]() .
.
Стандартный потенциал цепи (I), наряду с равновесными концентрациями нейтральной молекулы основания и заряженных частиц ![]() , образующихся в процессе титрования основания, оцененных по табл.2 и рис.1, и их коэффициентами активностей
, образующихся в процессе титрования основания, оцененных по табл.2 и рис.1, и их коэффициентами активностей ![]() , дают возможность определения термодинамических констант кислотности протонированных триоснований в среде органических растворителей.
, дают возможность определения термодинамических констант кислотности протонированных триоснований в среде органических растворителей.
Оценка активности лионий-ионов в процессе титрования основания возможна по уравнению Нернста:
![]() .
.
Рассматриваемая методика, отличающаяся от известных применением логарифмических зависимостей при оценке ионной силы и коэффициентов активности ионов, была апробирована на примере 1,3-дифенилгуанидина (ДФГ) в среде ДМФА. В литературе [7] известна величина рКа (ДФГ/ДМФА) = 9.1. Нами было [11] получено значение рКа (ДФГ/ДМФА) = 9.15 ± 0.03, свидетельствующее о достаточной надежности и воспроизводимости предлагаемого метода.
В табл. 2 сведены все исходные данные для расчетов констант диссоциации по уравнению (1) при титровании 0.03904 н. раствора 3,4,4´-триаминодифенилоксида, широко применяемого в синтезе полибензимидазолов, 0.1541 н. раствором хлорной кислоты в среде ацетона.
Как видно из таблицы и рисунка, равновесные концентрации частиц, находящихся в титруемом растворе, вполне сопоставимы. Поэтому в расчетах рКа все концентрации должны быть учтены. Протонированные трехкислотные основания характеризуются близостью констант кислотности, подтверждаемой одним совместным скачком потенциала на кривой потенциометрического титрования, которую мы здесь не приводим.
Рассчитанные в соответствующих буферных областях величины термодинамических констант диссоциации протонированного 3,4,4´-триаминодифенилметана в среде ацетона равны: рК1 = 7.99 ± 0.11, рК2 = 6.94 ± 0.11, рК3 = 5.82 ± 0.09.
Разработанная методика определения термодинамических констант кислотности протонированных оснований в среде органических растворителей вполне приемлема при экспериментальном определении рКа любых трехкислотных оснований при совместной нейтрализации функциональных групп.
Таблица 2. Расчет констант диссоциации протонированного 3,4,4´-триаминодифенилоксида в среде ацетона по ур.(1)
|
V, мл |
Е, В |
-lg a (лиония) |
[B] |
[BH+] |
[BH22+] |
[BH33+] |
I0.5 |
|
0.2 |
0.192 |
8.7512 |
0.029282 |
0.017193 |
0.003022 |
0.000389 |
0.128035 |
|
0.4 |
0.197 |
8.6672 |
0.029282 |
0.020863 |
0.003668 |
0.000472 |
0.141041 |
|
0.6 |
0.201 |
8.6000 |
0.029282 |
0.024356 |
0.004282 |
0.000552 |
0.152391 |
|
0.8 |
0.206 |
8.5159 |
0.029011 |
0.029282 |
0.005196 |
0.000669 |
0.167464 |
|
1.0 |
0.211 |
8.4319 |
0.023907 |
0.029282 |
0.006305 |
0.000812 |
0.175799 |
|
1.2 |
0.216 |
8.3479 |
0.019701 |
0.029282 |
0.007651 |
0.000986 |
0.185412 |
|
1.4 |
0.221 |
8.2638 |
0.016235 |
0.029282 |
0.009284 |
0.001196 |
0.196446 |
|
1.6 |
0.226 |
8.1798 |
0.013379 |
0.029282 |
0.011266 |
0.001451 |
0.209055 |
|
1.8 |
0.232 |
8.0799 |
0.010607 |
0.029282 |
0.014210 |
0.001831 |
0.226495 |
|
2.0 |
0.237 |
7.9949 |
0.008741 |
0.029282 |
0.017244 |
0.002221 |
0.243158 |
|
2.2 |
0.243 |
7.8941 |
0.006930 |
0.029282 |
0.021751 |
0.002802 |
0.265994 |
|
2.4 |
0.252 |
7.7428 |
0.004892 |
0.027826 |
0.029282 |
0.003970 |
0.300566 |
|
2.6 |
0.257 |
7.6588 |
0.004031 |
0.022931 |
0.029282 |
0.004817 |
0.302830 |
|
2.8 |
0.263 |
7.5580 |
0.003196 |
0.018180 |
0.029282 |
0.006076 |
0.308214 |
|
3.0 |
0.270 |
7.4403 |
0.002437 |
0.013866 |
0.029282 |
0.007966 |
0.318348 |
|
3.2 |
0.277 |
7.3227 |
0.001859 |
0.010575 |
0.029282 |
0.010445 |
0.332948 |
|
3.4 |
0.284 |
7.2050 |
0.001418 |
0.008066 |
0.029282 |
0.013695 |
0.352454 |
|
3.6 |
0.292 |
7.0706 |
0.001040 |
0.005918 |
0.029282 |
0.018664 |
0.381461 |
|
3.8 |
0.298 |
6.9697 |
0.000825 |
0.004692 |
0.029282 |
0.023542 |
0.408474 |
|
4.0 |
0.305 |
6.8521 |
0.000629 |
0.003578 |
0.027778 |
0.029282 |
0.434872 |
|
4.2 |
0.312 |
6.7344 |
0.000480 |
0.002729 |
0.021186 |
0.029282 |
0.418934 |
|
4.4 |
0.319 |
6.6168 |
0.000366 |
0.002082 |
0.016159 |
0.029282 |
0.406358 |
Продолжение табл. 2
|
V, мл |
f1 |
f2 |
f3 |
рК1 |
рК2 |
рК3 |
|
0.2 |
0.3811 |
0.1446 |
0.05492 |
8.101 |
- |
- |
|
0.4 |
0.3498 |
0.1218 |
0.04243 |
8.064 |
- |
- |
|
0.6 |
0.3252 |
0.1052 |
0.03404 |
8.032 |
- |
- |
|
0.8 |
0.2959 |
0.0870 |
0.02558 |
7.991 |
- |
- |
|
1.0 |
0.2812 |
0.0785 |
0.02192 |
7.969 |
- |
- |
|
1.2 |
0.2653 |
0.0698 |
0.01838 |
7.944 |
- |
- |
|
1.4 |
0.2485 |
0.0612 |
0.01508 |
7.915 |
- |
- |
|
1.6 |
0.2310 |
0.0528 |
0.01208 |
7.883 |
- |
- |
|
1.8 |
0.2093 |
0.0433 |
0.00895 |
- |
7.080 |
- |
|
2.0 |
0.1910 |
0.0360 |
0.00678 |
- |
7.040 |
- |
|
2.2 |
0.1692 |
0.0281 |
0.00469 |
- |
6.986 |
- |
|
2.4 |
0.1421 |
0.0198 |
0.00275 |
- |
6.908 |
- |
|
2.6 |
0.1405 |
0.0193 |
0.00266 |
- |
6.903 |
- |
|
2.8 |
0.1369 |
0.0183 |
0.00245 |
- |
6.892 |
- |
|
3.0 |
0.1304 |
0.0166 |
0.00211 |
- |
6.870 |
- |
|
3.2 |
0.1217 |
0.0144 |
0.00171 |
- |
6.839 |
- |
|
3.4 |
0.1113 |
0.0120 |
0.00130 |
- |
- |
5.909 |
|
3.6 |
0.0980 |
0.00929 |
0.000880 |
- |
- |
5.851 |
|
3.8 |
0.0875 |
0.00736 |
0.000620 |
- |
- |
5.800 |
|
4.0 |
0.0786 |
0.00592 |
0.000446 |
- |
- |
5.752 |
|
4.2 |
0.0838 |
0.00675 |
0.000543 |
- |
- |
5.781 |
|
4.4 |
0.0882 |
0.00749 |
0.000636 |
- |
- |
5.804 |
СПИСОК ЛИТЕРАТУРЫ:
- Александров В.В., Лебедь В.И., Шихова Т.М., Заславский Б.Г. // Электрохимия.-1968. -Т.4.- №6.- С.711.
- Альберт А., Сержент Е. Константы ионизации кислот и оснований.- М.-Л.: -Химия.- 1964.- 262 с.
- Анорганикум. -М.: Мир.-1984. -Т.2. -С.120.
- Бейтс Р. Определение рН. Теория и практика. - Л.: Химия.- 1972.- 400 с.
- Вайсбергер А., Проскауэр Э., Риддик Дж., Тупс Э. Органические растворители /Пер. с англ. М.: Издатинлит.- 1958.- 519 с.
- Гордон А., Форд Р. Спутник химика. -М.: Мир.-1976.- 541 с.
- Крешков А.П. Аналитическая химия неводных растворов. -М.: Химия.- 1982.-120 с.
- Танганов Б.Б. Химия и хим. технология. Деп. ОНИИТЭХим.1984. №976 хпД84).
- Танганов Б.Б. Химические методы анализа: Уч. пособ.-Улан-Удэ.- 2005.-550 с.
- Танганов Б.Б., Алексеева И.А. //ЖОХ.-2005.-Т.75.- Вып.11.-С.1775.
- Танганов Б.Б., Алексеева И.А. //ЖОХ.-2006.-Т.76.- Вып.11.-С. 1800.
- Davies C.W. // J.Chem.Soc.-1938.- P.2093.
- Speakman J.C. //J.Chem.Soc.-1940.- P.855.



