По данным генетического мониторинга во многих странах нарушения генома разной степени встречаются у 2-5% новорожденных, что влияет на показатели здоровья детского населения, а в будущем, и всей популяции. В структуре наследственных болезней доля тяжелых форм патологий составляет 2% [1,5,7]. Особенно остро стоит проблема детской заболеваемости, причиной которой являются наследственные заболевания (НЗ) и врожденные пороки развития (ВПР). Их вклад в структуру младенческой смертности уже достигает 20%. Лечение и инвалидизация таких детей является одной из причин снижения рождаемости. Установлено, что профилактика часто встречающихся НЗ (1:50000 и чаще) может на 50% снизить отягощенность этими патологиями [3]. Среди профилактических программ существенное место занимает мониторинг подобных болезней - система определения и контроля популяционных частот ВПР и НЗ, включающая изучение их динамики и этиологии, а также контроль тератогенов среды [2]. Подобного рода исследования служат основой для разработки мероприятий и рекомендаций по снижению риска и уровня ВПР и НЗ среди населения. Для проведения единого методического подхода обязательной регистрации подлежат наблюдаемые «внешние» пороки развития, легко выявляемые врачом, и пороки внутренних органов с высоким уровнем летальности, выявляемые при проведении цитологоанатомического исследования [3].
Сравнительный анализ результатов популяционно-генетических исследований на предмет составления регистра НЗ и ВПР проведен среди населения Муганской и Ширванской зон Азербайджана. В соответствии с правилами Европейского международного регистра ВПР (EUROCAT) [6], зарегистрированы наиболее легко диагностируемые врожденные аномалии: нарушения ЦНС, врожденные пороки сердца, врожденные патологии зрения, аномалии скелета, гемолитическая болезнь, большая талассемия, врожденная глухонемота, расщелина губы и/или неба, гемофилия, гипофизарный нанизм.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Материал собран в экспедиционных условиях в селах и в районных центрах Саатлинского, Сальянского, Джалилабадского районов Муганской зоны, а также Кобустанского и Ахсуинского районов Ширванской зоны с 2004 по 2005 гг. Для выявления больных с врожденной и наследственной патологией использованы списки ВТЭК ЦРБ. В селах при подворовом обходе семей пробандов составлены родословные и путем генеалогического анализа дифференцированы случаи ВПР и НЗ. Фенотипические частоты выявленных патологий определяли по методике Ли Ч. [4]. В качестве материала для анализов использовали образцы крови, забор которой производили из пальца в микропробирки с антикоагулянтом (гепарин или натриевая соль этилендиаминтетраацетата). Для выявления β-талассемии и недостаточности фермента глюкозо-6-фосфатдегидро-геназы среди школьников использованы скрининг-программы [8]. При идентификации типа мутации β-талассемии использован молекулярный метод высокотемпературной аллель-специфической амплификации, основанный по принципу метода полимеразно-цепной реакции [7,11]. Для выявления наследственных гемоглобинопатий использован метод электрофореза гемоглобина на ацетат-целлюлозных пленках и аналитический метод изоэлектрофокусирования гемоглобинов в полиакриламидно-амфолиновых пластинках c рН 3,5-9,5 [9,10].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Сравнительный анализ медико-генетических исследований, проведенных в Муганской и Ширванской зонах республики, свидетельствуют о высокой распространенности ВПР и НЗ в обследуемых районах (рис.1). Так, в Муганской зоне (I) установлено 27 клинических форм патологий с фенотипической частотой, варьирующей в пределах 0,0017 - 0,0429%, и 23 формы с частотой 0,0076 - 0,1388% в Ширванской зоне (II). Из рис.1 видно, что среди общей структуры заболеваемости наиболее распространены нарушения ЦНС и составляют, соответственно, 43,89% и 37,84%. Структура указанных пороков развития представлена наиболее обширно: в I зоне - до 13 форм, во II зоне - 8 клинических форм. На втором месте по распространенности в I зоне находятся аномалии скелета - 20,72%, во II - врожденные патологии зрения - 13,70%. По остальным патологиям наблюдается относительное единство. Так, среди популяций I и II зон врожденные пороки сердца встречаются с частотой 6,10 и 6,05%; врожденная глухонемота - 6,94 и 6,02%;гемолитическая болезнь - 7,21 и 6,88%; расщелина губы и/или неба - 6,84 и 5,19%; гемофилия - 2,67 и 3,04%; большая талассемия - 2,89 и 1,30%; гипофизарный нанизм - 1,98 и 2,63%, соответственно.
Сравнительный анализ фенотипических частот изученных патологий показал, что среднее значение данных показателей во II зоне выше, чем в I (табл.1).
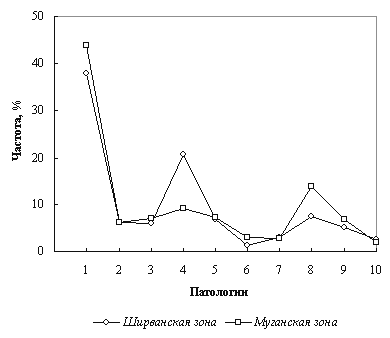
Рис. 1. Частота ВПР и НЗ среди населения Муганской и Ширванской зон
1. Нарушение ЦНС; 2. Врожденные пороки сердца; 3. Глухонемота; 4. Аномалии скелета; 5. Гемолитическая болезнь; 6. Большая талассемия; 7. Гемофилия; 8.Врожденные пороки зрения; 9. Расщелина губы/нёба; 10. Гипофизарный нанизм.
Таблица 1. Фенотипические частоты патологий, установленных в Муганской и Ширванской зонах республики
|
Патологии |
Фенотипические частоты (среднее значение), %
|
||||
|
Муганская зона |
Ширванская зона |
||||
|
Саатлы |
Сальян |
Джалилабад |
Кобустан |
Ахсу |
|
|
Нарушение ЦНС |
0,0098 |
0,0108 |
0,0077 |
0,0520 |
0,0353 |
|
Врожденные пороки сердца |
0,0114 |
0,0231 |
0,0067 |
0,0490 |
0,0610 |
|
Глухонемота |
0,0114 |
0,0123 |
0,0117 |
0,0653 |
0,0458 |
|
Аномалии скелета |
0,0030 |
0,0055 |
0,0020 |
0,0300 |
0,0397 |
|
Гемолитическая болезнь |
0,0229 |
0,0169 |
0,0100 |
0,0735 |
0,0534 |
|
Большая талассемия |
0,0031 |
0,0077 |
0,0050 |
0,0082 |
0,0153 |
|
Гемофилия |
0,0031 |
0,0062 |
0,0050 |
0,0163 |
0,0382 |
|
Врожденные пороки зрения |
0,0252 |
0,0143 |
0,0067 |
0,0109 |
0,0496 |
|
Расщелина губы /неба |
0,0257 |
0,0123 |
0,0100 |
0,0408 |
0,0534 |
|
Гипофизарный нанизм |
- |
0,0046 |
- |
- |
0,0229 |
При этом отмечено различие в проявлении частоты тех или иных пороков за исключением гемолитической болезни, средняя фенотипическая частота которой в обеих зонах максимальная - во II зоне - 0,0635%, в I - 0,0166%, и гипофизарного нанизма со сравнительно небольшой частотой - 0,0229% и 0,0046%, соответственно. Далее в I зоне следуют: расщепление губы и/или неба - 0,0160%, врожденные пороки зрения - 0,0154%, врожденные пороки сердца - 0,0137%, глухонемота - 0,0118%, нарушения ЦНС - 0,0094%, большая талассемия - 0,0053%, гемофилия - 0,0048%, аномалии скелета - 0,0035%. Во II зоне: глухонемота - 0,0556%, врожденные пороки сердца - 0,0550%, расщепление губы и/или неба - 0,0471%, нарушения ЦНС - 0,0437%, аномалии скелета - 0,0349%, врожденные пороки зрения - 0,0303%, гемофилия - 0,0273%, большая талассемия - 0,0118%.
Учитывая высокую частоту распространения b-талассемии в Азербайджане, актуальным является вопрос идентификации типа мутаций для данного заболевания. В Муганской зоне установлены несколько типов мутаций для b-талассемии. Так, при обследовании одной из семей в Саатлинском районе установлено, что мать имела точечную мутацию - замену нуклеотида гуанин на нуклеотид цитозин в 5-ой позиции первого интрона b-глобинового гена с фенотипом b+-талассемии (b+-IVS-1-5, Г-Ц), отец - точечную мутацию, замену нуклеотида гуанин на нуклеотид аденин в 110-ой позиции первого интрона b-глобинового гена с фенотипом b+-талассемии (b+-IVS-1-110, Г-А). Следовательно, больные дети с диагнозом большая b-талассемия имели генотип: b+-IVS-1-5, Г-Ц / b+-IVS-1-110, Г-А. Учитывая репродуктивный возраст супругов, в ближайшей перспективе планируется проведение в первом триместре беременности (10-12 недель) пренатальную диагностику талассемии у плода. В Сальянском регионе идентифицировано три типа мутации b-талассемии: замена нуклеотида гуанин на аденин в первом интроне 110-го кодона глобинового гена - IVS-1-110 (Г-A); замена нуклеотида гуанин на аденин в первом кодоне второго интрона глобинового гена - IVS-2-1, (Г-A) и микроделеция двух нуклеотидов аденин глобинового гена - кодон 8 (-AA). В Джалилабадском районе для трех гомозигот по β-талассемии идентифицировано два типа мутации: замена нуклеотида гуанин на аденин в 110 позиции первого интрона β- глобинового гена (β-IVS-1-110, Г-A) и микроделеция двух нуклеотидов аденин восьмого кодона первого экзона β- глобинового гена (β-кодон 8 -АА). Среди населения Кобустанского и Ахсуинского регионов Ширванской зоны у трех больных с диагнозом большая талассемия идентифицировано два типа мутации β-глобинового гена (β-ГГ): замена нуклеотида аденин на нуклеотид гуанин в 110 позиции первого интрона β-ГГ (β-IVS-1-110, А-Г) и делеция двух нуклеотидов аденин в 8-ом кодоне первого экзона β-ГГ (β-кодон 8 -АА). Соотношение аллелей β-IVS-1-110, А-Г и β-кодон 8 -АА составило 4/2.
Изученные патологии информативны для организации быстрого мониторинга популяций, необходимого для исследования структуры общего генофонда, генного разнообразия популяций и составления регистра патологий, использующегося для квалифицированного медико-генетического консультирования семей с проведением пренатальной диагностики заболеваний.
СПИСОК ЛИТЕРАТУРЫ
- Демикова Н.С. Система мониторинга врожденных пороков развития в Российской Федерации. http://expo.medi.ru/%20cmz03-tezis-detstvo.htm
- Демикова Н.С., Козлова С.И. Мониторинг врожденных пороков развития. // Вестник РАМН. 1999. 11. С. 29.
- Кобринский Б.А., Демикова Н.С. Принципы организации мониторинга врожденных пороков развития и его реализация в Российской Федерации. // Российский вестник педиатрии и перинатологии, 2001. Т. 46. №4. С. 55.
- Ли Ч. Введение в популяционную генетику. М.: Мир, 1978, 546 с.
- Новиков П.В. Основные направления профилактики, ранней диагностики и лечения врожденных и наследственных болезней у детей. http://expo.medi.ru/cmz03-tezis-detstvo.htm
- Пузырев В.П., Эрдыниева Л.С., Кучер А.Н., Назаренко Л.П. Генетико-эпидемиологическое исследование населения Тувы. - Томск: STT, 1999. 256 с.
- Шостакович-Корецкая Л.Р., Маврутенков В.В., Братусь Е.В., Маврутенкова Т.В. Полимеразно-цепная реакция: принципы и практические рекомендации по использованию в клинической практике врача (руководство для врачей). / Днепропетровск: МЗ Украины, 2002. 26 с.
- Modell B. The ethics of prenatal diagnosis and genetic counseling. // World Health Forum. 1990. 11. P.179.
- Morengo-Rowe A.J. Rapid electroforesis on cellulose acetate. // J. Clin. Pathology. 1965. 18. P. 790.
- Rasulov E. Express-methods of hemoglobinopathy dignosis in newborns. // Journal of molecular genetics, microbiology, virusology. 1990. 1. P. 27.
- Saiki R. K., Scharf S., Faloona F., Mullis K. B., Horn G. T., Erlich H. A., Arnheim N. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. // Science. 1985. 230. P. 1350.



