Организация научных исследований в вузах предполагает проведение фундаментальных исследований изучающих законы развития природы и общества, что повышает качество образования, т.к. наука - это база на которой основывается учебный процесс. Для успешного проведения таких исследований необходимо наличие научных школ, создание условий для эффективного использования научно-педагогического потенциала, а также вовлечение в исследование студентов и аспирантов.
В настоящее время кафедрой физической химии Тверского государственного университета и кафедрами естественнонаучных дисциплин Клинского института экономики и права и Тверского института экологии и права ведутся работы по проекту РФФИ 07-03-96403-рЦентр-а «Термохимическая кинетика радикальных реакций: математическое моделирование».
В течение многих лет, заявленный в проекте, коллектив ведет расчетно-теоретическое исследование по проблеме "Связь свойств веществ со строением молекул: математическое (компьютерное) моделирование" (номер гос. регистрации в ТвГУ 01.84.0085361), которая входит в Перечень приоритетных направлений химической науки. В центре внимания целенаправленный поиск новых структур, алгоритмы решения ряда теоретико-графовых и комбинаторных задач, возникающих в ходе сбора и обработки информации о структуре и свойствах веществ, создание экспертных информационных систем и баз данных, разработка количественных методов расчета и прогнозирования [1-3].
Нами разработаны методы перечисления изомеров замещения молекулярных полиэдров, методы теории графов для исследования корреляций "структура - свойство" органических молекул, методы квантовой химии и статистической термодинамики. Созданы оригинальные методики расчета на ЭВМ термохимических свойств органических веществ с точностью, сопоставимой с погрешностями эксперимента. Все эти разработки находят применение и в данном проекте.
Проект связан с разработкой расчетных методов исследования элементарных газофазных реакций радикального распада и замещения соединений вида:
ЭН4-lХl , ЭН3-lXl-ЭН3-l´Хl´ ,... ЭН4-l-mХlYm , ... ; ЭН3-lХl , ... ; ЭН2-lХl , ...
(Э = С, Si, Ge, ... ; Х,Y,... = D, T, F, Cl, Br, I, CH3, NO2, ... ).
Нами проанализированы состояния числовых данных по термохимическим и характеристикам радикальных реакций распада и замещения, выполнены численные расчеты энтальпий образования молекул и свободных радикалов, средних энергий связей и энергий разрыва связей, тепловых эффектов, энергий активаций и их численные расчеты в рядах выбранных соединений.
Так, например, для реакций радикального распада и замещения вида:
ЭН4-lХl ⇒ ЭН3-lХl + Н, ЭН4-lХl ⇒ ЭН4-lХl-1 + Х
R + ЭН4-lХl ⇒ RH + ЭН3-lХl , M + ЭН4-lХl ⇒ MX + ЭН4-lХl-1
(Э = С, Si, ... ; Х = F, Cl, ... ; R = D, Cl, CH3, ... ; M = Na, ... ).
Тепловые эффекты данных реакций есть не что иное, как энергии разрыва связей в исходной молекуле. Значит,
qD(1) l = a D(1) +bD(1)l+cD(1)l2 (l = 0, 1, 2, 3), qD(2) l = a D(2) +bD(2)l+cD(2)l2 (l = 1, 2, 3, 4).
qS(1)l = aS(1) + bS(1)l+cS(1)l2 (l = 0, 1, 2, 3), qS(2)l = aS(2) + bS(2)l + cS(1)l2 (l = 1, 2, 3, 4),
где aS(1), bS(1), сS(1), ... - некоторые параметры.
В таком же виде можно представить и энергии активаций
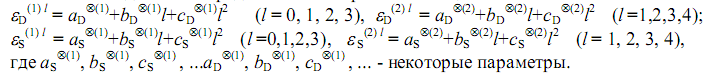
В табл. 1. приведены экспериментальные [4] и предсказанные энергии активаций ряда реакций радикального распада и замещения Х-замещённых метана. Звездочкой здесь помечены значения, вычисленные нами с использованием квадратичной (частично, линейной) зависимости.
Таблица 1. Энергии активации реакций радикального распада и замещения (в кДж/моль)
|
Уравнение реакции |
εl |
Уравнение реакц |
εl |
|
СН3I = СН3 + I |
226 |
СF3NO2 = СF3 + NO2 |
268* |
|
С2Н5I= С2Н5+I |
218 |
СF2(NO2)2 = СF2NO2+NO2 |
198 |
|
(СН3)2СНI=(СН3)2СН+I |
193 |
СF(NO2)3= СF(NO2)2+NO2 |
175 |
|
(СН3)3СI=(СН3)3С+I |
189 |
С(NO2)4= С(NO2)3 + NO2 |
160 |
|
СН3NO2 = СН3 + NO2 |
228 |
СCl3 NO2 = СCl3 + NO2 |
154 |
|
С2Н5NO2 = С2Н5+NO2 |
218* |
СCl2(NO2)2 = СCl2 NO2+NO2 |
143 |
|
(СН3)2СНNO2=(СН3)2СН+NO2 |
225* |
СCl(NO2)3= СCl(NO2)2+NO2 |
152 |
|
(СН3)3СNO2=(СН3)3С+NO2 |
249* |
С(NO2)4= С(NO2)3 + NO2 |
160 |
|
СН2(NO2)2 = СН2NO2+ NO2 |
200* |
Н+СН3Cl = HCl +СН3 |
30,1 |
|
СH3CH(NO2)2=СH3CHNO2+NO2 |
197 |
H+СН2Cl2=HCl+СН2Cl |
24,3 |
|
(СН3)2С(NO2)2=(СН3)2NO2+NO2 |
211 |
H+СНCl3= HCl +СНCl2 |
18,0 |
|
СН3С(NO2)3=СН3С(NO2)2+NO2 |
181 |
H +СCl4= HCl +СCl3 |
13,8 |
На основе анализа экспериментального и расчетного материала выявлены определенные закономерности в рядах однотипных реакций, построены графические зависимости вида «Свойство - степень замещения».
Несомненно, проведение фундаментальных исследований на базе конкретных учебных заведений способствует развитию вузовской науки, приобщению аспирантов и студентов к научным изысканиям, к расширению теоретических познаний и приобретению практических навыков.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 07-03-96403-рЦентр-а)
СПИСОК ЛИТЕРАТУРЫ:
- Папулов Ю.Г., Виноградова М.Г.. Расчетные методы в атом-атомном представлении: Монография. Тверь: ТвГУ, 2002. 232 с.
- Папулов Ю.Г., Виноградова М.Г. Энергия химических связей: основные закономерности и методы расчета: Обзор //Вестн. ТвГУ. Сер. Химия.2006.№ 3. С.5-39.
- Виноградова М.Г., Папулов Ю.Г. Методология расчёта энергий химических связей.//Современные проблемы развития фундаментальной науки: по результатам регионального конкурса РФФИ 2006 года. - Тверь: Лилия Принт, 2006 . С.9-14.
- Веденеев В.И., Кибкало А.А. Константы скорости газофазных мономолекулярных реакций. М.: Наука, 1972. 164 с.



