Липополисахариды грамотрицательных микроорганизмов вызывают сложный гуморальный и клеточный ответ через индукцию цитокинов и других медиаторов из клеток иммунной системы макроорганизма, которые инициируют генерализованную воспалительную реакцию, в результате чего на терминальной стадии формируются гипотензия, сердечно-сосудистые расстройства и мультиорганная патология [4]. ЛПС Y. pestis индуцирует развитие эндотоксинового шока, являющегося главной причиной высокой летальности при чумной инфекции [3]. Клинические испытания показали, что метилпреднизолон в высокой дозе не снижает уровень смертности и не предотвращает развития септического шока [7]. В связи с этим проводятся исследования возможности коррекции отдельных патологических проявлений эндотоксикоза с помощью цитокинов [10].
Цель настоящего исследования заключалась в испытании защитных свойств гомологичных хелперных фракций нейтрофилокинов при чумной интоксикации на оппозитных по чувствительности к глюкокортикоидам экспериментальных животных (белые мыши, морские свинки).
Нами испытаны препараты хроматографических фракций нейтрофилокинов, полученных методом гель-фильтрации на сефадексе G-75. Анализ показал, что фракции являются продуктами полипептидной и белковой природы. Молекулярные массы, которые установили методом электрофореза в полиакриламидном геле, соответствовали 85, 62 и 10 кДа. Фракции различались по количеству белков. Во фракциях нейтрофилокинов, полученных от иммунных животных, содержание белка было выше, чем в соответствующих фракциях от неиммунизированных живой чумной вакциной животных. Предварительное исследование пула нейтрофилокинов от интактных и иммунных животных с помощью моноклональных антител к различным цитокинам выявило, что отдельные фракции содержали активность ИЛ-1, ИЛ-6 и ФНО-α. Пул нейтрофилокинов содержал также ряд других низкомолекулярных биологически активных пептидов, не блокировавшихся МКА к вышеперечисленным цитокинам, поскольку они и после блокады стимулировали пролиферацию лимфоцитов. Предварительно испытывали действие фракций нейтрофилокинов на функции иммунокомпетентных клеток при первичном и вторичном противочумном иммунитете. Результаты показали, что некоторые фракции оказывали хелперное, другие - супрессорное действие. Так, фракции низкомолекулярных пептидов (~ 10 кДа) усиливали киллерную активность макрофагов. Наиболее активным стимулирующим эффектом обладали фракции нейтрофилокинов, полученные от иммунных животных. Фракции нейтрофилокинов с наиболее выраженным хелперным действием были испытаны в качестве альтернативного гидрокортизону средства.
|
|
|
|
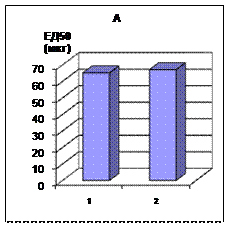
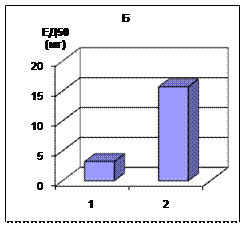
Рис.1 Сравнительная характеристика влияния гидрокортизона при чумной интоксикации, вызванной Y. pestis EV (1) и ЛПС чумного микроба (2) у оппозитных по чувствительности к глюкокортикоидам животных: А - белые мыши Б - морские свинки. По оси абсцисс: 1.- Y. pestis EV 2.- ЛПС чумного микроба. По оси ординат: ЕД50 гидрокортизона в мкг (для белых мышей) и в мг ( для морских свинок).
|
|
Биопробным животным внутрибрюшинно вводили смертельную дозу (2ЛД50) культуры или ЛПС чумного микроба [5], полученного по методу Вестфаля и дефосфорилированного по оригинальной методике, разработанной в лаборатории иммунологии РостНИПЧИ. ЛД50, оттитрованные в предварительных экспериментах, составили 1,7 и 380 млрд м. кл. и 435 и 692 мкг ЛПС для мышей и свинок соответственно .
|
|
|
|
Рис.2 Сравнительная характеристика действия гомологичных хелперных фракций нейтрофилокинов при чумной интоксикации, вызванной Y. pestis EV (1) и ЛПС чумного микроба (2) у оппозитных по чувствительности к глюкокортикоидам животных: А - белые мыши Б - морские свинки. По оси абсцисс: 1.- Y pestis EV 2.- ЛПС чумного микроба. По оси ординат: ЕД50 фракций нейтрофилокинов в мкг белка в мл. |
|
Двукратные разведения гидрокортизона ацетата (или сукцината) или испытуемые гомологичные фракции нейтрофилокинов в изотоническом растворе хлористого натрия вводили заражённым животным подкожно в объёме 0,2 мл и определяли величину ЕД50 гидрокортизона и нейтрофилокинов [2]. Заражали по 4 группы животных по 6 мышей или свинок в каждой. Контрольным группам вводили 2ЛД50 культуры или ЛПС без лечения или наивысшую испытанную дозу гидрокортизона или фракций нейтрофилокинов без культуры или токсина. Гибель животных после введения смертельной дозы культуры наступала через 3 часа, а липополисахаридного токсина чумного микроба - через 2, (белые мыши), свинок - через 4 и 3 часа соответственно. Сроки введения гидрокортизона или нейтрофилокинов подбирались таким образом, чтобы препарат начинал действие на пике развития процесса интоксикации и выделения ФНО-α [11] - за 30-40 минут до гибели животных в контрольной группе. Учёт результатов производили через 24 часа.
Результаты терапии гидрокортизоном инфекционно-токсического и эндотоксинового шока у белых мышей и морских свинок представлены на рисунке 1. ЕД50 гидрокортизона для мышей составляла 65 и 67 мкг при инфекционно- токсическом и эндотоксиновом шоке соответственно, для морских свинок - 3,2 и 15,7 мг. Проведенные исследования доказали возможность коррекции чумного токсического шока у животных с различной чувствительностью к кортикостероидам [8]. При этом дозы гидрокортизона, способные снять патологические симптомы, приближаются к тем, которые рекомендованы для сенсибилизации биопробных животных [1]. Следует также учитывать, что введение экзогенных глюкокортикоидов может вызвать усугубление течения патологических процессов [6].
Известно, что лимфоидные клетки крыс, кроликов и обезьян чувствительны к глюкокортикоидным гормонам, а лимфоциты человека и морских свинок - относительно резистентны [8]. Резистентность лимфоидных клеток морских свинок к глюкокортикоидам, - физиологическим индукторам апоптоза, - сочетается с тем, что введение этих гормональных препаратов не вызывает у них снижения уровня ФНО-α, активность которого обусловливает развитие всей картины инфекционно-токсического шока [9].В связи с этим мы изучили возможность использования для профилактики чумной интоксикации гомологичных хелперных фракций нейтрофилокинов, синтезированных нейтрофилами иммунизированных чумной вакциной мышей и свинок и стимулированных in vitro Y. pestis EV 76. На рисунке 2 представлены результаты, показавшие, что для мышей ЕД50 фракций нейтрофилокинов составила 6,3 и 0,41 мкг белка, а для морских свинок ЕД50 фракции нейтрофилокинов при инфекционно-токсическом чумном шоке составляет 10,6 мкг белка, при эндотоксиновом - 11,5 мкг.
Таким образом, введение гомологичных фракций нейтрофилокинов лабораторным животным оказывало защитное действие и предотвращало их гибель при чумной интоксикации. При этом следует отметить, что наивысшие испытанные дозы нейтрофилокинов не вызывали гибели животных в контрольных группах, что открывает новые подходы к коррекции иммунопатологических сдвигов, возникающих при чумной интоксикации, в том числе эндотоксемии.
СПИСОК ЛИТЕРАТУРЫ:
- Айкимбаев А.М., Темиралиева Г.А., Ахмедьянова Н.К. /Проблемы специфической профилактики чумы и холеры.- Саратов.-1985.- С. 38-41.
- Ашмарин И.П., Воробьев А.А. Статистические методы в микробиологических исследованиях. - Л.: Медгиз, 1962. - 180 с.
- Дмитровский А.М. / Материалы межгосударственной научной конференции «Профилактика и меры борьбы с чумой», посвящ. 100-летию открытия возбудителя чумы.- Алмааты.-1994.-С.15-16.
- Рябченко Е.В., Веткова Л.Г., Бондаренко В.М. // Журн. микробиол.- 2004.- № 3.- С. 98-105.
- Терновой В.И., Козырева Л.А., Голотина М.Б., Глянько Е.В. / Микробиология, биохимия и спцифич. Профилактика карантинных инфекций.- Саратов.- 1990.- С.59-66.
- Челова Л.А. /Лаб. диагностика, биохимия и спец. проф. чумы и холеры.- Саратов.- 1986.- С. 32-40.
- Bone R., Fisher C., Clemmer T. et al. //N.Engl.J.med.- 1987.- Vol. 317, 2,-p.653-658.
- Claman H. //N. Engl. J. med.- 1972.-Vol.287,-1.- p.388-397.
- Tracey K., Lawry S., Cerami A. // J. infect. dis.- 1988.-157.- P. 413-419.
- Wahl A., Wallace P.M. //Ann. Rheum. Dis. - 2001. - 60 (3): P. 75-80.
- Zuckеrman S.H., Bendele A.M. //Inf.immun.- 1989. - Vol.57, №10.-P. 3009-3013.