Ранее нами синтезирована гетероциклическая система пирролоакридина, в которой акридин - типично π-электронодефицитный гетероцикл сочленен с π-электроноиз-быточным пиррольным фрагментом. Биохимический аспект подобного рода конденсированных систем чрезвычайно интересен, поскольку в живых организмах π-избыточная система пиррола участвует в процессах, связанных с передачей нервных импульсов и деятельностью центральной нервной системы; некоторые π-дефицитные гетероциклы, в том числе и акридин, обладают своеобразным мутагенным действием, что предопределяет поиск среди них противоопухолевых препаратов. Конденсированная система пирролоакридина также показала различные виды биологической активности, в связи с чем нами продолжен синтез производных пирролоакридина и исследование физиологической активности этих соединений.
В данной работе описан синтез 6-амино-3н-пирроло[2,3-с]акридина, который удалось получить прямым аминированием пирролоакридина по реакции Чичибабина.
Известно, что акридин медленно реагирует с амидом натрия и только после трехчасового нагревания реакционной смеси при 1800С в деметиланилине выделяют 9-аминоакридин с 31% выходом.
Использовав условия проведения аминирования 3Н-пирроло[2, 3-c]акридина, описанные для акридина, нами уже после двухчасового нагревания реакционной смеси было обнаружено отсутствие исходного соединения и был выделен 6-амино 3Н-пирроло[2,3-с]акридин с 43% выходом. Следует отметить, что образование аминопроизводного хроматографически наблюдалось уже при 1500С.
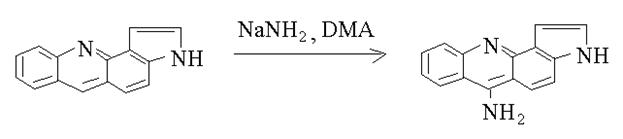
Такой результат указывает на близкую, в качественном аспекте, реакционную активность акридина и пирролоакридина в реакции Чичибабина, что согласуется с ранее сделанным выводом на основе квантово-механического расчета и данных ПМР спектра пирролоакридина, согласно которым влияние π-электронодонорного пиррольного фрагмента практически не сказывается на электронной плотности углеродного атома в γ-положении к азоту пиридинового цикла и величина π-заряда близка к величине заряда в акридине.
Реакции аминирования пирролоакридина благоприятствует, по-видимому, и большая основность его по сравнению с акридином, что согласуется с развиваемыми в настоящее время представлениями о механизме реакции Чичибабина.
Структура 6-амино-3Н-пирроло[2,3-c]акридина доказана элементным анализом и находится в соответствии со спектральными данными.
В спектре ПМР 6-амино-3Н-пирроло [2,3-c]акридина отсутствует низкопольный синглет протона Н6, а в области 4, 9 м.д. появляется сигнал протонов аминогруппы. Влияние группы NH2 приводит к низкопольному смещению сигналов Н7 и Н5 по сравнению с пирролоакридином.
В ИК спектре 6-амино-3Н-пирроло[2,3-c]акридина появляются полосы поглощения группы, в виде дублета в области 3200 - 3230 см-1 и широкая полоса поглощения группы NH пиррольного цикла в области 3350 см-1.
В УФ спектре 6-амино-3Н-пирроло[2,3-c]акридина отмечен батохромный сдвиг основных полос поглощения, что особенно выражено для длинноволновых максимумов по сравнению с пирролоакридином.
В качестве побочного продукта реакции выделено вещество, почти не растворимое во многих органических растворителях, с нечеткой температурой плавления, структуру которого установить не удалось. Видимо это смесь биспроизводных пирролоакридина разной степени гидрирования.
Проведено исследование противоопухолевой активности 6-амино-3Н-пирроло[2,3-c]акридина на аденокарциноме молочной железы, опухоли рака легкого и аденокарциноме толстой кишки. 6-амино-3Н-пирроло[2,3-c]акридин оказался активным на аденокарциноме толстой кишки. В настоящее время ведутся дополнительные исследования физиологической активности этого соединения.



