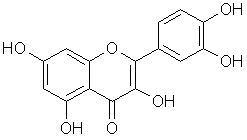
Если флавоноиды представляют собой класс природных соединений, широко представленный в составе экстрактивных веществ практически любых высших растений [1], то кверцетин - 3¢,4¢,5,7-тетрагидроксифлавонол, I - является одним из самых распространенных флавоноидов. Это утверждение легко проверить, сопоставив частоты упоминания соединений этого класса в сети Internet (Google). По этому критерию кверцетин уступает только одному флавоноиду - рутину, который является гликозидом того же кверцетина (3-О-рутинозид). Другим свидетельством широкой известности этого соединения можно считать тот факт, что в Универсальной десятичной классификации в качестве примера соединений, кодируемых дескриптором 547.814.5, приведен именно кверцетин.
 I)
I)
Можно полагать, что это одно из самых распространенных природных соединений должно быть охарактеризовано надежными значениями всех физико-химических констант. Для соединений, содержащих функциональные группы с активными атомами водорода (в том числе фенольные гидроксильные группы) к числу наиболее важных характеристик относят их константы диссоциации. Тем удивительнее, что до настоящего времени значения рКа (I) по данным различных литературных источников не согласуются между собой. Некоторые из величин рКа (I), опубликованные в работах 1988-2008 г.г., приведены в Табл. 1. Подобная ситуация заставляет 1) объяснить причину аномально большого разброса значений рКа и 2) устранить ее с целью определения надежного значения константы диссоциации кверцетина.
Таблица 1. Некоторые значения рКа кверцетина по данным различных литературных источников
|
Значение рКа |
Год |
Метод определения |
|
8.21 |
1988 |
I |
|
7.03 |
1998 |
II |
|
~ 5 (оценка) |
2001 |
- |
|
6.9 ± 0.6 |
2005 |
Нет данных |
|
8.9 |
2005 |
III |
|
7.65 |
2006 |
II |
|
7.59 ± 0.06 |
2008 |
III |
|
8.30 |
2008 |
II |
*) I - потенциометрическое титрование, II - спектрофотометрическое титрование, III - капиллярный зонный электрофорез.
Для определения pKa навески дигидрата кверцетина (20-22 мг, Sigma) растворяли в 100 мл 50% этанола (рН исходных растворов 4.6-4.8) и прибавляли 25-50 мкл Твина-80 [полиоксиэтилированный (20) моноолеат сорбита; неионогенный детергент]. Перед началом потенциометрического титрования через раствор при температуре 20.0 ± 0.5 0С и перемешивании барботировали приблизительно 50 мл азота со скоростью около 10 мл/мин, после чего ток азота уменьшали до ~ 5 мл/мин и продолжали его барботирование в течение всего времени титрования 0.01 М водным раствором NaOH. За счет барботирования азота на поверхности титруемого раствора образуется слой заполненных инертным газом пузырьков, которые полностью изолируют его от контакта с воздухом. Типичный вид кривой титрования (I) в условиях предотвращения его окисления растворенным в воде кислородом воздуха приведен на Рис. 1.
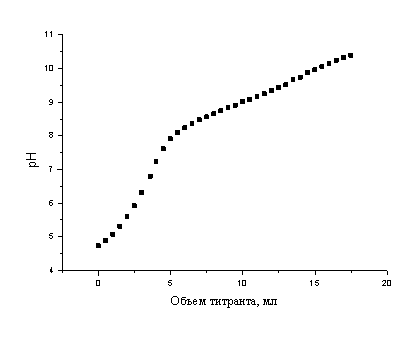
Рис. 1. Типичный вид зависимости рН раствора кверцетина от объема титранта при потенциометрическом титровании в условиях предотвращения его окисления растворенным кислородом воздуха
Вместо азота с целью удаления растворенного кислорода воздуха из титруемого раствора (I) можно использовать любой другой инертный газ (гелий, аргон). Более того, принципиально допустимо применение бытового газа (метан), но не СО2 (реагирует с титрантом).
Равновесная концентрация кислорода в воде, находящейся в контакте с воздухом (часто используют термин «растворимость») при нормальных условиях (н.у.: 200С, 760 мм рт. ст.) составляет 8.8-9.4 мг/л (0.29 ммоль/л) [2-4]. В органических растворителях в тех же условиях его содержание существенно выше. Основное электронное состояние парамагнитного О2 - триплет 3Sg-, так что такую молекулу не только можно изображать в виде бирадикала (.О-О.), но и основные реакции О2 типичны для свободных радикалов. Молекулярный кислород при н.у. достаточно быстро окисляет в водных растворах даже такие стабильные соединения как алкиларены [5].
Окисление кверцетина (I) кислородом воздуха известно с 1912 г., однако длительное время полагали, что этот процесс может протекать только в насыщенных кислородом неводных растворителях в присутствии сильных оснований при нагревании [6]. Только в 2007 г. было подтверждено, что окисление (I) наблюдается и в водных растворах при комнатной температуре даже в слабощелочной среде (рН > 7), причем с увеличением рН его скорость значительно возрастает [7]. Окисление (I) приводит к полному разрушению g-пиронового фрагмента молекулы (цикл С); при этом образуются различные промежуточные соединения, одним из конечных продуктов превращения которых является смешанный эфир 2,4,6-тригидроксибензойной и 3,4-дигидроксибензойной кислот (так называемый депсид), гидролизующийся далее до солей соответствующих кислот. Это позволяет предположить, что одной из причин наблюдаемого несоответствия констант диссоциации (I) друг с другом является именно легкое окисление кверцетина в процессе титрования растворенным кислородом воздуха. Образование содержащих гидроксильные группы промежуточных продуктов окисления (I) приводит к существенному искажению результатов.
Для подтверждения этого утверждения можно сопоставить воспроизводимость значений рКа какого-либо соединения, устойчивого к окислению при н.у. (например, фенола) в сравнении с результатами для простейшего вещества, легко окисляющегося в щелочных растворах (например, гидрохинона). Из соответствующих оценок, приведенных в Табл. 2, следует, что если для стабильного фенола стандартное отклонение значений рКа составляет 0.04 при вариации всех значений в диапазоне 0.1, то близкое значение pKaI способного к окислению гидрохинона уже характеризуется стандартным отклонением 0.2 в диапазоне вариаций (размах) 0.6. Что же касается величины pKaII, то она соответствует более высоким значениям рН, когда процессы окисления аналита выражены в большей степени, так что ее стандартное отклонение закономерно возрастает до 0.7 при размахе 1.7. Подобный же разброс наблюдается и для значений констант диссоциации кверцетина, значительно легче окисляющегося кислородом воздуха по сравнению с гидрохиноном.
Таблица 2. Сравнение воспроизводимости значений рКа соединений, стабильных (фенол) и не стабильных (гидрохинон) в растворах в присутствии кислорода воздуха
|
Соединение |
Некоторые известные значения рКа (Internet) |
Среднее значение |
Размах [диапазон (рКа)макс - (рКа)мин] |
|
Фенол |
9.9, 10.0, 9.98, 9.89, 9.98, 9.99, 9.96 |
9.96 ± 0.04 |
0.1 |
|
Гидрохинон (pKaI) |
9.8, 9.85, 10.35, 10.4, 9.96, 9.9, 9.91, 10.2, 9.8-10.0 |
10.0 ± 0.2 |
0.6 |
|
то же (pKaII) |
11.32, 11.4, 13.0, 12.04, 11.56 |
11.9 ± 0.7 |
1.7 |
Для устранения эффектов, обусловленных процессами окисления аналитов, стандартная процедура потенциометрического титрования должна быть модифицирована. Оптимальным, по мнению авторов, способом, легко воспроизводимым в любых лабораториях, оказалось выдувание растворенного в образцах кислорода воздуха инертным газом (азотом). Такая процедура аналогична подготовке элюентов для высокоэффективной жидкостной хроматографии, когда их продувают гелием для удаления следов растворенного воздуха. Однако одной этой процедуры недостаточно, так как при слабом токе азота и интенсивном перемешивании титруемого раствора нельзя избежать его контакта с атмосферным воздухом. Поэтому окончательные рекомендации включают добавку к образцу минимальных количеств неионогенного детергента (использован Твин-80) для того, чтобы закрыть поверхность титруемого раствора слоем заполненных азотом пузырьков; устойчивость этого слоя обеспечивается именно присутствием ПАВ. Такой прием позволяет полностью устранить контакт раствора с атмосферным воздухом и, следовательно, избежать окисления (I) в процессе титрования. Контрольные опыты показали отсутствие влияния подобных добавок на результаты.
Стандартная обработка результатов титрования (I) с использованием предлагаемого способа (Рис. 1) дает среднее значение рКа по данным параллельных опытов 6.62 ± 0.04. Из доступных литературных данных оно лучше всего согласуется с величиной 6.9 ± 0.6, определенной в работе [8], стандартное отклонение которой в 15 раз больше. Как следует из рассмотрения приведенного выше примера (см. Табл. 2), столь невысокая точность определений в работе [8] может быть связана именно с частичным окислением аналитов в процессе титрования.
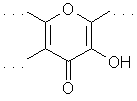
Значение рКа (I) 6.62 значительно меньше, чем величины рКа фенолов (типичный диапазон 8 - 10), что может быть обусловлено особыми свойствами группы ОН в положении 3. На правомерность такого предположения указывает сравнение значения рКа (I) с данными для 2-гидроксициклогептатриен-1-она (трополон, II, рКа 6.92, содержащего в молекуле структурный фрагмент, аналогичный структуре цикла С молекулы кверцетина (гидроксильная группа в ароматической системе в a-положении к карбонильному фрагменту):
 I)
I) 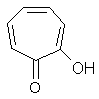 II)
II)
Определенное в условиях, исключающих окисление (I) в процессе титрования значение рКа 6.6, означает, что кверцетин и, возможно, другие флавонолы, содержащие в молекулах такой же фрагмент структуры, при рН ~ 7.4 (типичное значение рН физиологических жидкостей) практически полностью находится в диссоциированном состоянии. Этот вывод представляется весьма важным как для интерпретации химических свойств, так и для характеристики биологической активности соединений рассматриваемого класса.
Кроме легко выявляемого участка кривой титрования (I), соответствующего рКа 6.6, на ней можно даже визуально различить аномалию в области рН ~ 9-10 (Рис. 1). Ее появление можно объяснить существованием второго значения рКаII кверцетина (9.7 ± 0.2), которое проявляется достаточно слабо, так как кверцетин при рН > 6.6 в соответствии с полученными данными существует в водных растворах уже в диссоциированной форме.
Большинство известных ранее значений рКа кверцетина (см. Табл. 1) было определено с использованием спектрофотометрического титрования. Однако опасность окисления (I) растворенным кислородом воздуха при этом существенно выше, так как такой способ обычно требует больших затрат времени, а контакт титруемых растворов с атмосферным воздухом не может быть эффективно исключен. Эффекты окисления (I) проявляются уже при рН > 7, что специально проиллюстрировано рисунком, приведенным в статье [7].
Предложенный модифицированный вариант потенциометрического титрования позволяет исключить окисление аналитов кислородом атмосферного воздуха, растворенным в титруемых растворах, и может быть рекомендован не только для флавоноидов, но и для легко окисляющихся веществ других классов.
СПИСОК ЛИТЕРАТУРЫ:
- Flavonoids. Chemistry, Biochemistry and Applications. Eds: O.M.Andersen, K.R.Markham. N.Y.: CRR Taylor & Francis, 2005. 1237 p.
- Battino R., Rettich T.R., Tominaga T. // J. Phys. Chem. Ref. Data. 1983. V. 12. № 2. P. 163-178.
- Vesilind P.A., Morgan S.M. Introduction to Environmental Engineering. 2nd Edn. Boston: Brooks/Cole Publ. Co., 2003. 479 p.
- Abraham M.H., Whiting G.S., Carr P.W., Onyang H. // J. Chem. Soc. Perkin Trans, 1998. №2. P. 1385-1390.
- Зенкевич И.Г., Ищенко Е.В., Макаров В.Г., Макарова М.Н., Селезнева А.И. // Журн. общей химии. 2008. Т. 78. № 9. С. 1449-1456.
- Brown S.B., Rajananda V., Holroyd J.A., Evans E.G.V. // Biochem. J. 1982. V. 205. P. 239-244.
- Zenkevich I.G., Eshchenko A.Yu., Makarova S.V., Vitenberg A.G., Dobryakov Yu.G., Utsal V.A. // Molecules. 2007. V. 12. № 3. P. 654-672.
-
Dubber M.-J. Application of CE, HPLC, LC-MS-MS for the analysis and quality control of Ginkgo Biloba dosage forms. Thesis. Rhodes University, Greece, 2005. Цит. по: http://eprints.ru.ac.za/294/01/MJ_Dubber_PhD.pdf



