Умелое использование сокровищницы мировой культуры учителем обеспечивает эффективное развитие естественнонаучного интеллекта и формирование мировоззрения школьников. Если к окончанию школы у выпускника будет сформировано научное мировоззрение, можно с полной уверенностью утверждать, что школу покидает высоконравственная личность, для которой чуждо безнравственное поведение. Более того научное мировоззрение и только оно поможет молодому человеку противостоять тем негативным явлениям, с которыми он встретится в жизни.
Для российского учителя интеллектуальное наследство, оставленное человечеству великим патриотом и гениальным учёным М.В. Ломоносовым, - незаменимый рабочий инструмент педагогической практики. Предопределяя интеграцию научных знаний, он считал: "химия - правая рука физики, математика - её глаза, так как последняя указывает путь к правильному суждению"[7,45]. Пройдёт два столетия и к 200 летию Московского государственного университета им. М.В. Ломоносова Маргарита Алигер напишет:
О, физика - наука из наук!
Всё впереди!
Как мало за плечами!
Пусть химия нам будет вместо рук.
Пусть станет математика очами.
Не разлучайте этих трёх сестёр
познания всего в подлунном мире,
тогда лишь будет ум и глаз остёр
и знанье человеческое шире. [1, 99].
М.В. Ломоносов был истинным испытателем природы, он постоянно видел великие и необъяснимые явления природы. Поэт в душе, он приходил в поэтический восторг от тех же явлений, которые с величайшим интересом изучал как натуралист. Вот почему в поэзии М.В. Ломоносова почти нет картин природы, её красок, настроения, но есть явления природы. Изумительным подтверждением этого служат строки из его поэмы "Пётр Великий"
Лишает долгий зной здоровья и ума;
А стужа в севере ничтожит вред сама.
Сам лёд, что кажется толь грозен и ужасен,
от оных лютых бед даст ход нам безопасен [5, 303].
Не менее убедителен фрагмент письма к его высокородию Ивану Ивановичу Шувалову:
Чертоги светлые, блистание металлов
Оставив, на поля спешит Елисавет;
Ты следуешь за ней, любезный мой Шувалов,
Туда, где ей Цейлон и в севере цветёт,
Где хитрость мастерства преодолев природу,
Осенним дням даёт весны прекрасный вид
И принуждает вверьх скакать высоко воду,
Хотя ей тягость вниз и жидкость течь велит [5, 250].
Поэзия М.В. Ломоносова - типичная поэзия естествознания, знакомство с которой расширяет естественнонаучные знания школьников, обогащает интеллект.
Развитию творческих способностей дети во многом обязаны интересу, возникающему у них и поддерживаемому на уроках за счёт фрагментов художественных произведений, авторы которых описывают явления, непосредственно относящиеся к изучаемой теме. Так, при характеристике аллотропного видоизменения углерода - алмаза отрывок из рассказа профессора И.А. Ефремова "Алмазная Труба", не нарушая логические связи излагаемого материала, окажет положительное влияние на приращение естественнонаучного потенциала школьника. "На белом листе рассыпались мелкие кристаллы - столбчатые, призматические, многоугольные - красного, бурого, чёрного, голубого, зелёного цветов. Это были сопутствующие алмазу ильменит, пироксен, оливин и другие стойкие минералы. А среди них, подобно кусочкам стекла и всё же не сходные с ним своим сильным блеском, выделялись мелкие кристаллы алмазов. Здесь были белые, чистой воды камни, были и покрытые шероховатой бурой корочкой. Некоторые кристаллы имели розоватый или зелёный оттенок.
- Вот посмотрите, кроме октаэдров - ромбододекаэдр (двенадцати-гранник, каждая грань которого имеет очертание ромба). - Чурилин отделил спичкой зелёный двенадцатигранник. - Этот вид алмаза отличается необыкновенной даже для этого камня твёрдостью. " [3, 280].
Описанные свойства алмазов обусловлены условиями их образования в земной коре. И об этом профессор И.А. Ефремов не менее увлекательно повествует в романе приключений "Лезвие бритвы". "Берег Скелетов - побережье пустыни Намиб в Юго-Западной Африке. . . . На южном продолжении пустыни Намиб , на побережье Намакваленда, алмазы находятся в огромном количестве. . . .
Берег Скелетов - это край древнего африканского горба земной коры, который беспрерывно поднимается в течение уже миллионов лет. Потому здесь смыты все верхние покровы горных пластов до самых древних пород основания земной коры. Геологи совсем недавно определили возраст этих пород в пять миллиардов лет, то есть он близок к возрасту нашей Галактики. Здесь выпучиваются земные недра, залегающие под гранитной корой, тяжёлые, рассланцованные давлением породы из особой разновидности гранита - эклогиты. Оттуда сквозь трещины пробиваются под гигантским давлением струи раскалённых и сжатых до предела газов, несущие драгоценные алмазы вместе с разрушенными эклогитами. Южно-Африкан-ский древний материк весь пронизан алмазными трубами, как, по-види-мому, и похожий на него древний материк в центре Сибири" [4, 184-186].
Не оставит равнодушными школьников фрагмент из повести К.Г. Паустовского "Золотая роза". "Аквамарин (алюмосиликат бериллия 3BeO . Al2O3 . 6SiO2 авт.) считается по своему имени (аква марин - морская вода) камнем, передающим цвет морской волны. Это не совсем так. В прозрачной его глубине есть оттенки мягкого зеленоватого цвета и бледной синевы. Но всё своеобразие аквамарина заключается в том, что он ярко освещён изнутри совершенно серебряным (именно серебряным, а не белым) огнём.
Кажется, если вглядеться в аквамарин, то увидишь тихое море с водой цвета звёзд.
Очевидно, эти цветовые и световые особенности аквамарина и других драгоценных камней и вызывают у нас чувство таинственности"[8, 240].
Не оспорим тот факт, что информация, получаемая школьниками из подобных высоко художественных и глубоко научных произведений, закладывает надёжные основы их естественнонаучных способностей. Успешное же развитие этих способностей и интеллекта учащихся происходит при работе с теми литературными произведениями и другими источниками информации, которые ограничиваются лишь описанием явлений, и требуют творческого подхода к их расшифровке.
Ниже приводится отрывок из итогового философского сочинения Иогана Вольфгана Гёте трагедии "Фауст".
Являлся красный лев и был он женихом,
И в тёплой жидкости они его венчали
С прекрасной лилией, и грели их огнём,
И из сосуда их в сосуд перемещали.
И вслед - блиставшую лучами всех цветов
Царицу юную в стекле мы получали:
Целительный напиток был готов.
И стали мы лечить. Удвоились мученья:
Больные гибли все без исключенья,
А выздоравливал ли кто,
Спросить не думали про то.
Вот наши подвиги леченья!
Средь этих гор губили мы
Страшней губительной чумы! [2, 38]
Расшифровка превращений, описанных таким иносказательным языком с применением таинственных обозначений, требует глубоких знаний, творческого подхода и нередко фантазии. Можно предложить следующие интерпретации описанных превращений.
Версия 1. Красный лев - это сера. Прекрасная лилия - это ртуть. Сера непосредственно реагирует со ртутью
Hg + S ⇒ HgS.
Сульфид ртути взаимодействует с царской водкой при нагревании
3HgS + 8HNO3 + 6HCl ⇒ 3HgCl2 + 3H2SO4 + 8NO↑ + 4H2O.
Версия 2. Красный лев - это или сульфид ртути HgS или оксид ртути HgO (и то и другое соединения красного цвета). Тёплая жидкость - это азотная кислота HNO3. Прекрасная лилия - это кристаллы хлорида натрия NaCl.
Взаимодействие смеси с азотной кислотой при нагревании может быть описано либо уравнением
3HgS + 8HNO3 + 6NaCl ⇒ 3HgCl2 + 3Na2SO4 + 8NO↑ + 4H2O,
либо уравнением
HgО + 2HNO3 + 2NaCl ⇒ HgCl2 + 2NaNO3 + H2O
Можно предположить, что, переливая из сосуда в сосуд, алхимики освобождались от побочных продуктов, чтобы получить целительный напиток - сулему HgCl2. Конечно же, больные гибли, так как сулема - сильно действующее ядовитое вещество, хотя оно и применяется для лечения ряда заболеваний. Но возможно, что алхимики не могли ещё знать точную дозировку этого лекарства, поэтому больные гибли все без исключения.
Предлагая учащимся поработать над расшифровкой подобных описанному превращений, учитель оказывает благотворное влияние на развитие их воображения, на способность выдвигать оригинальные идеи, активизирует у учащихся творческую деятельность.
Ключевой составляющей системы развития естественнонаучного потенциала школьников продолжает оставаться приобщение одарённых детей к решению нестандартных оригинальных задач высокого уровня.
Среди подобных задач наиболее продуктивными следует признать задачи, содержащие элемент обучения уже в условии. Например,
Задача 1. В "Основах химии" Д.И. Менделеева [6, 291] находим следующее о минерале азурите: ". . . встречается часто медная синь или лазурь, которая заключает те же элементы, как и малахит . . .".
Определите состав азурита, если известно, что при нагревании выше 300 0С он разлагается, образуя чёрный порошок и теряя в массе 30,8 % . Последующее прокаливание чёрного порошка в токе водорода приводит к потере 20,1 % (масс.) и превращению его в красно-розовый порошок. Приведите химическое уравнение реакции взаимодействия азурита с избытком серной кислоты.
Решение. Исходя из данных условия задачи о наличии в составе азурита тех же элементов, что и в составе малахита, можно предположить, что его термическое разложение описывается следующим химическим уравнением:
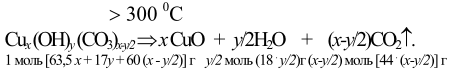
1 моль [63,5 x + 17y + 60 (x - y/2)] г y/2 моль (18 . y/2)г (x-y/2) моль [44 . (x-y/2)] г
При термическом разложении 1 моль азурита он теряет
[18 . y/2 + 44 . (x-y/2)] г, что составляет 30,8 % от его молярной массы, то есть
[63,5 x + 17y + 60 (x - y/2)] . 0,308 = 18 . y/2 + 44 . (x-y/2).
Преобразовав данное математическое уравнение, получим:
(123,5 x - 13 y) . 0,308 = 44 x - 13 y; 6 x = 9 y; x : y = 3 : 2.
Тогда состав азурита: Cu3(OH)2(CO3)2 или Cu(OH)2 . 2 CuCO3 .
Восстановление оксида меди (II) в токе водорода описывается следующим химическим уравнением:
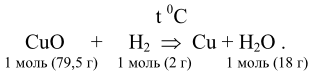
При восстановлении 1 моль CuO в токе водорода происходит потеря (18 - 2) г кислорода, что, согласно условию задачи, составляет 20,1% от молярной массы оксида. Действительно, 79,5 . 0,201 = 16 г.
Взаимодействие азурита с избытком серной кислоты описывается химическим уравнением:
Cu(OH)2 . 2 CuCO3 + 3 H2SO4 ⇒ 3 CuSO4 + 2 СО2↑ + 4 H2O .
Задача 2. В романе Ж. Верна "Таинственный остров" описано, как в 1865 году во время гражданской войны Севера и Юга в США пятерых беглецов из осаждённого Ричмонда ураган унёс на воздушном шаре и забросил на затерянный в океане остров. В поисках удобного жилища спутники оказались в карстовых пещерах с причудливо свисающими с потолка и верхней части стен сталактитами, натёчными минеральными образованиями, возникающими в результате просачивания природных вод через трещины в сводах пещеры, образования насыщенного раствора солей, содержащихся в растворимых горных породах, и его последующей кристаллизации.
Оцените элементный состав сталактитов. Назовите соль, извлекаемую из горных пород подземными водами. Почему условия карстовых пещер благоприятствуют образованию и росту сталактитов? Сколько лет потребуется для достижения сталактитом массы 500 кг, если известно, что скорость просачивания подземных вод -1 капля в час, объём капли - 0,5 мл, а минерализация раствора - 0,01 моль/л ?
Решение. Карстовые пещеры образовывались в горных породах, растворимых в природных водах. С потолка и верхней части стен карстовых пещер свешиваются натёчные минеральные образования (чаще известковые, основной компонент которых имеет состав CaCO3) - сталактиты в виде сосулек, бахромы.
Из горных пород подземными водами извлекается известняк CaCO3 . В присутствии углекислого газа воздуха он растворяется в природных водах, что описывается следующим химическим уравнением:
CaCO3 + H2O + CO2 ⇔ Ca(HCO3)2 .
При обычной температуре в процессе испарения раствора, содержащего Ca(HCO3)2, осаждается CaCO3. Этот процесс лежит в основе образования сталактитов и их роста.
Используя приведённое в условии задачи значение минерализации раствора и полагая, что она обусловлена карбонатом кальция CaCO3, можно рассчитать массу его в 1 л раствора:
m(CaCO3) = М(CaCO3) . ν(CaCO3)=100 г/моль .0,01моль = 1 г .
Тогда масса сталактита, данная в условии задачи, будет содержаться в растворе, объём которого V(раствора) = 500 . 10 3 л.
Воспользовавшись данными условия задачи, можно рассчитать число капель в этом объёме раствора:
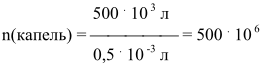
и время, необходимое для натекания этого числа капель:

Задача 3. "Азотносеребряная соль AgNO3 , известная в практике под именем ляписа (lapis infernalis), получается растворением в азотной кислоте металлического серебра. Если для растворения взято нечистое серебро, то в растворе получается смесь азотномедной и азотносеребряной солей. Если такую смесь испарить досуха, а затем остаток осторожно сплавить до температуры начала каления, то вся азотномедная соль разлагается, а большинство азотносеребряной соли не изменяется. Обрабатывая сплавленную массу водой, извлекают эту последнюю, тогда как окись меди остаётся нерастворимою"[6, 303-304].
Напишите химические уравнения реакций, происходящих при растворении "нечистого серебра" в азотной кислоте и при осторожном сплавлении (изменением нитрата серебра пренебречь) до температуры начала разложения сухого остатка, образовавшегося при испарении смеси; определите массовую долю (%) серебра в образце "нечистого серебра", если при растворении 2,00 г "нечистого серебра" масса остатка после разложения равна 3,07 г; определите массу осадка, образующегося при добавлении избытка раствора хлорида натрия к раствору, полученному растворением 2,00 г "нечистого серебра" в азотной кислоте.
Решение. Превращения, описанные в условии задачи, могут быть представлены в виде следующих химических уравнений:
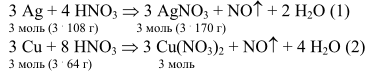
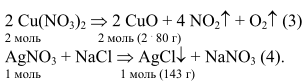
Пусть масса серебра в образце - х г, тогда масса меди в образце - (2 -х) г.
Как следует из химического уравнения (1),
ν(AgNO3) = ν(Ag) = х г /108 г/моль = х /108 моль,
а m(AgNO3) = М(AgNO3) . ν(AgNO3) = 170 г/моль . х /108 моль = 170х /108 г.
Как следует из химических уравнений (2) и (3),
ν(CuO) = ν(Cu) = (2 -х) г / 64 г/моль = (2 -х)/64 моль,
а m(CuO) = М(CuO) . ν(CuO) = 80 г/моль . (2 -х)/64 моль = 80 . (2 -х)/64 г.
Воспользовавшись данными условия задачи, можно составить уравнение: m(AgNO3) + m(CuO) = 3,07 г. Подставив в него выражения для m(AgNO3) и m(CuO) и решив относительно х, получим: х = 1,76. Следовательно, масса серебра в образце m(Ag) =1,76 г, а его массовая доля ω(Ag) = 1,76 г . 100 % / 2,00 г = 88 % .
Как следует из химического уравнения (4),
ν(AgCl) = ν(AgNO3) = 1,76 г / 108 г/моль = 0,0163 моль;
а m(AgCl) = M(AgCl) . ν(AgCl) = 143 г/моль . 0,0163 моль = 2,33 г.
Задача 4. Древние индейцы Южной Америки использовали для извлечения золота из золотоносных пород нагревание их с влажной смесью чилийской селитры, поваренной соли и алюмокалиевых квасцов. Алхимиками был предложен более простой способ перевода золота в раствор, основанный фактически на тех же химических превращениях.
Напишите химическое уравнение реакции растворения золота по методу алхимиков. Объясните, используя ионные уравнения, процессы, протекающие при растворении золота по рецепту индейцев.
Решение. Для растворения золота алхимики предложили использовать "царскую водку" - смесь концентрированных соляной и азотной кислот. Протекающее при этом взаимодействие описывается следующим химическим уравнением:
Au + HNO3 + 4 HCl ⇒ H[AuCl4] + NO↑ + 2 H2O
(окислительный потенциал образования однозарядного комплексного аниона [AuCl4]- меньше потенциала образования иона Au3+). В ионной форме это уравнение имеет вид:
Au + NO3- + 4 Cl- + 4 H + ⇒ [AuCl4]- + NO↑ + 2H2O.
Растворение золота протекает в сильно кислой среде при одновременном присутствии нитрат- (окислитель) и хлорид- (комплексообразователь) ионов.
По рецепту древних индейцев при нагревании смеси происходило обезвоживание алюмокалиевых квасцов:
В воде, выделяющейся при нагревании смеси, растворялись квасцы, нитрат натрия (чилийская селитра) и хлорид натрия (поваренная соль). Соль алюминия подвергалась гидролизу, который можно описать следующим химическим уравнением:
Al 3+ + H2O ⇔ Al(OH) 2+ + H+ (H3O+).
Cтепень гидролиза при повышении температуры увеличивалась так же, как и окислительный потенциал системы. Присутствие нитрат-, хлорид-ионов и ионов водорода способствовало растворению золота.
Неоднократное обращение учащихся к учебной и научной литературе при решении нестандартных задач высокого уровня, разочарование, нередко испытываемое от неумения найти правильное решение, формируют у них такие ценные качества личности как наблюдательность, трудолюбие, умение преодолевать растерянность, трудности, интуиция, настойчивость в достижении поставленной цели. Желательно, чтобы путеводной звездой для всех российских детей, накопивших в школьные годы естественнонаучный потенциал, стали вдохновенные слова ратника мировой культуры М.В. Ломоносова
О вы, которых ожидает
Отечество от недр своих
И видеть таковых желает,
Каких зовёт от стран чужих,
О. ваши дни благословенны!
Дерзайте ныне ободренны
Раченьем вашим показать,
Что может собственных Платонов
И быстрых разумом Невтонов
Российская земля рождать [5, 127]
Литература
- Алигер М.И. Собрание сочинений. В 3-х т. Т.2. Стихотворения, 1945-1980. М.: Худ. лит-ра, 1985. 511 с.
- Гёте И.В. Фауст. Петразаводск: Изд-во "Карелия", 1975. 176 с.
- Ефремов И.А. Собрание сочинений. В 6-ти т. Т.1. Рассказы. М.: Современный писатель, 1992. 544 с.
- Ефремов И.А. Собрание сочинений. В 6-ти т. Т.4. Лезвие бритвы. Роман приключений. М.: Современный писатель, 1992. 656 с.
- Ломоносов М.В. Избранные произведения. М.-Л.: Советский писатель, 1965. 579 с.
- Менделеев Д.И. Основы химии. В 2-х т. Т. 2. М.-Л.: Гос. науч.-техн. изд-во хим. лит-ры, 1947. 707 с.
- Меншуткин Б.Н. Жизнеописание Михайла Васильевича Ломоносова. М.-Л.: Изд-во АН СССР, 1937. 238 с..
- Паустовский К.Г. Поэтическое излучение. Повести. Рассказы. Письма. М.: Молодая гвардия, 1976. 432 с.



