Гели, твердообразные дисперсные системы с высоким содержанием влаги, широко применяются в косметической, фармацевтической и пищевой промышленности. Значительная часть косметических и лекарственных препаратов, продуктов питания имеет гелевую структуру. Гелеобразование происходит в результате действия стабилизаторов, связывающих воду и образующих за счет связей нефлуктуационной природы пространственную сетку, которая пронизывает весь объем системы и удерживает растворитель. К стабилизирующим ингредиентам относятся протеины и полисахариды - природные биополимеры, молекулы которых дифильны и образуют структуру с повторяющимися лиофильными и лиофобными участками.
Действие стабилизаторов обусловлено конформационным уплотнением макромолекулярных структур (утолщающий эффект) и специфичным межцепочным взаимодействием в узловых зонах (структурный эффект). В результате действия указанных факторов в системе значительно изменяются вязкость, предельное напряжение сдвига, время релаксации протонов, фиксируемые методами вискозиметрии [1]. Следует также учесть, что свойства воды, как дисперсионной среды, удерживаемой в геле, и свободной воды различны. Связанную воду классифицируют на три категории - воду, связанную с полярными центрами, кластерную воду и гидрофобную. Одной из характеристик гель-связанной воды является уменьшение ее подвижности, фиксируемое методом Н+ЯМР-релаксации [2-6].
Цель работы cостоит в изучении конформационных изменений и межцепочных взаимодействий в протеин-полисахаридных системах на основе анализа релаксационных явлений крахмал-казеиновых гелей (казеин - основной белок молока), образуемых при введении крахмала в обезжиренное молоко. Для установления влияния казеина на гелеобразующую способность крахмала в качестве контроля применяли водно-крахмальные растворы при соответствующих концентрациях полисахарида.
Крахмал состоит из двух полисахаридов - амилозы и амилопектина, образованных остатками глюкозы. Амилоза растворима, амилопектин - нерастворимая часть крахмала, образующая гель. Макромолекула амилозы имеет линейную структуру, состоящую из остатков α-Д-глюкопиранозы, соединенных α-1,4-гликозидными связями и свернутую в спираль, причем на один виток спирали приходится 6 пиранозных фрагментов. Спираль стабилизирована водородными связями между СНОН- и ОН- группами при С (2).
Амилопектин состоит из остатков α- Д - глюкозы, связанных
α - 1-4-гликозидными связями. Основная цепь содержит кластеры a-1,6 связанных глюкозных остатков. В геометрическом отношении макромолекула амилопектина имеет разветвленную структуру. Связи С-О по обе стороны пиранозного кольца непараллельны; связь при С(1) аксиальная, при С(4) экваториальная. В результате упорядоченной конформацией цепи (вторичная структура полисахарида) является спираль [7,8]. Для крахмала характерна третичная структура - двойная спираль типа НН - две «вкрученные» друг в друга спирали с общей осью. Четвертичная структура представляет собой объединение третичных структур с образованием клубка. Молекулярная масса крахмала, найденная нами методом высокоэффективной жидкостной хроматографии [9] (хроматограф 1090 М фирмы Хъюлетт-Паккард), составляет 87 - 131 кD. Содержание крахмала в водной и молочной средах изменялось в диапазоне 1 - 15 мас.%.
Белки молока имеют глобулярную структуру, представлены казеинами α-,β- ,Χ- и γ- (2,4 - 3,0 мас.%), а также сывороточными белками -
β-лактоглобулином (0,2 - 0,4 мас.%) и a-лактоальбумином (0,06 - 0,17 мас.%). Основной протеин молока (α-казеин) состоит из 4 фракций, отличающихся электрофоретической подвижностью, молекулярной массой, составом и последовательностью аминокислот в полипептидной цепи. Состоящая из аминокислот полипептидная цепь (первичная структура белка) образует спираль (вторичная структура) вследствие взаимодействия заряженных групп аминокислот. При реализации водородных связей между отдельными кольцами спирали макромолекула принимает форму клубка - глобулы (субмицеллы) с ориентацией гидрофобных групп к ее внутренней части, гидрофильных - к внешней. Субмицеллы объединяются в мицеллы при участии коллоидного фосфата кальция, причем внешний слой мицеллы состоит преимущественно из c- казеина, представляющего собой гликопротеид, ориентированный гликозидной группой к водной дисперсионной среде.
Таким образом, глобулярные белки характеризуются следующими общими признаками: компактной формой, близкой к сферической, расположенной во внутренней части глобулы информацией о первичной структуре белка и гидрофильными группами на поверхности макромолекулы, которая является полиионом. В изученных нами гетерогенных системах a-казеин находится в виде казеинат-кальций-фосфатного комплекса, ассоциирован в мицеллы диаметром 130 - 160 нм со средней молекулярной массой до108 .
Измерения методом Н+ЯМР выполняли на импульсном спектрометре низкого разрешения «Протон-20», диапазон изменения температур 10 - 40оС. Зависимость спада протонной поперечной релаксации от времени, а также ее заселенности изучали при импульсной последовательности CPMG (τ = 1,0 и 2,0 млс, время повторных запусков 4 с, число накоплений 9); зависимость восстановления продольной релаксации и ее заселенности от времени - при импульсной последовательности 90оС-τ- 90оС [10].
Экспериментальные релаксационные кривые спадов поперечной намагниченности (А) во времени для водно-крахмальных и молочно-крахмальных систем в полулогарифмических координатах имеют экспоненциальный характер, на релаксационных кривых перегиб отсутствует (рис.1). Время продольной и поперечной релаксаций (Т1, Т2) рассчитывали с применением модели одно-экспоненциального спада (табл.1).
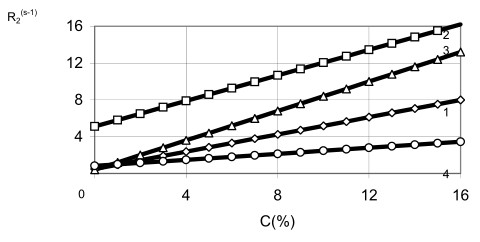
Рис.1. Спады поперечной намагниченности образцов крахмальных гелей на основе обезжиренного молока при содержании крахмала (мас. %): 0 (1); 5,0 (2); 10 (3), 15,0 (4).
Таблица 1. Значения продольной (Т1) и поперечной (Т2) релаксаций, их заселенность для крахмалсодержащих систем, 20 0С
|
Образец |
Т2 ,млс |
Т1 , млс |
R2 , c-1 |
R1 , c-1 |
|
Цельное молоко без крахмала |
193,1 |
1275,0 |
5,2 |
0,8 |
|
Молочно-крахмальная система (15 % мас. крахмала) |
71,0 |
319,0 |
14,1 |
3,1 |
|
Водно- крахмальная система (15% мас.крахмала) |
223,0 |
627,0 |
4,5 |
1,6 |
|
Молочно- крахмальная система (10% мас.крахмала) |
90,9 |
382,0 |
11,0 |
2,6 |
|
Водно- крахмальная система (10% мас.крахмала) |
304,0 |
860,0 |
3,3 |
1,2 |
|
Молочно-крахмальная система (5% мас.крахмала) |
121,5 |
654,0 |
8,2 |
1,5 |
|
Водно- крахмальная система (5% мас.крахмала) |
600,6 |
1224,0 |
1,7 |
0,8 |
Согласно модели Уоспера и Циммермана [10] экспоненциальный характер протонной релаксации воды в сложных гетерогенных системах интерпретируется, как результат обмена между протонными фракциями с различными временами релаксации (Т2,1). Единая измеряемая скорость релаксации (1/Т2общ) определяется как сумма релаксационных вкладов каждой фракции:
1/Т2общ = Σ1/Т2 (1)
Для водно-крахмальных систем суммируются релаксационные вклады свободной воды 1/Тfw и воды, иммобилизованной полимером 1/Тр (полимерный вклад). Для молочно-крахмальных систем вклад в наблюдаемое время релаксации вносит также фракция молекул воды, иммобилизованных на казеиновых мицеллах, лактозе, минеральных солях. Полимерный релаксационный вклад вычисляют по уравнению (2):
1/Tp = f n(T2bw+τ), (2)
где f - мольная доля мономеров полимера (крахмала) относительно воды, n - число сайтов связывания молекул воды мономером биополимера, Т2bw - время релаксации протонов связанной воды, τt - время «жизни» молекул воды в связанном состоянии.
С позиции принятой релаксационной модели скорость релаксации в исследованных системах линейно связана с концентрацией крахмала (С), что подтверждается экспериментальными зависимостями скоростей поперечной и продольной релаксаций от концентрации крахмала (рис.2).
Величины свободных членов в корреляционных уравнениях 1/Т1 = 0,08С + 0,41 и 1/Т2 = 0,27С + 0,45 близки к скорости релаксации чистой воды (при 20 0С для чистой воды Т2 = 2,02 с и Т1 = 2, 51 с). Угловой коэффициент аппроксимирующих прямых характеризует релаксационную эффективность крахмала, его иммобилизующую способность по отношению к воде, поскольку зависит от количества молекул воды, приходящихся на 1 моль полимера.
Концентрационные зависимости для молочно-крахмальных систем сохраняют линейный характер (рис.2) и свидетельствуют об увеличении коэффициента релаксационной эффективности в 2 раза (1/Т1 = 0,16С + 0,83; 1/Т2 = 0,70С + 5,12), что подтверждает увеличение числа структурных контактов. Возрастание свободного члена в корреляционных уравнениях до значения, характерного для цельного молока (1/T2m = 5,2 с-1), - ожидаемый результат, поскольку в систему добавляется новый источник релаксации - фракция молекул воды, связанных с казеином и лактозой.
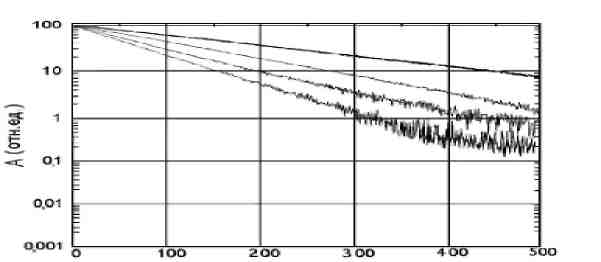
Рис.2. Зависимость скорости продольной (1,2) и поперечной (3,4) релаксаций от концентрации крахмала для водно-крахмальных (1,3) и молочно-крахмальных (2,4) систем.
Время релаксации связанной воды определяется подвижностью полимера в месте связывания, а также различной чувствительностью продольной и поперечной релаксаций к медленным движениям, характерным для биополимерных систем при образовании надмолекулярных структур (гелей). Время продольной релаксации практически нечувствительно к медленным движениям, поэтому для констатации структурных изменений в исследованных гетерогенных системах изучали температурную зависимость поперечной релаксации (рис. 3). Эта взаимосвязь иллюстрирует различную направленность температурного влияния на параметры Т2bw и t в уравнении (2): с увеличением температуры Т2bw уменьшается, t возрастает. Очевидно, что при 10 - 40оС влияние температуры для водно-крахмальных гелей определяется изменениями t, т. е. в водно-крахмальных системах при рН 6,8 - значении, соответствующем рН обезжиренного молока, образуются гелеподобные структуры. Увеличение вклада крахмала в релаксационную активность воды в молочной дисперсионной среде, вероятно, связано с сокращением параметра Т2bw, что подтверждается изменением углового коэффициента температурной зависимости поперечной релаксации (рис.3). Снижение Т2bw свидетельствует о появлении более медленных движений белок-крахмальных ассоциатов.
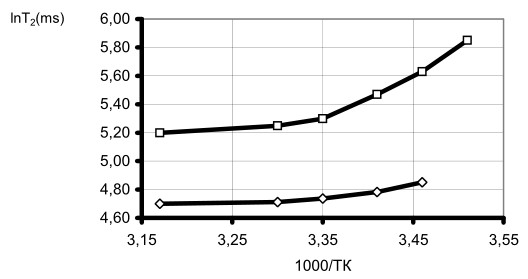
Рис.3. Температурная зависимость поперечной релаксации Т2
для молочно-крахмальной (1) и водно-крахмальной (2) систем;
содержание крахмала 15 мас.%.
Механизм гелеобразования заключается в образовании узлов студневой сетки в результате конформационного упорядочивания молекул. Образованию сетки способствует ассоциация биополимеров, которая проявляется в комплексной коацервации с последующим гелеобразованием. Гели, образованные в результате агрегации комплексов белок-полисахарид, называются комплексными. Изменение релаксационнй эффективности крахмала и увеличение t свидетельствуют о синергизме гелеобразования. Отрицательно заряженные мицеллы казеина включаются в сетку, сформированную крахмалом, взаимодействуя с положительно заряженными участками спирали макромолекулы крахмала. При этом возможно конформационное изменение строения мицеллы казеина, ее распад на субмицеллы, которые, в свою очередь, взаимодействуют с сеткой крахмального геля, увеличивая количество контактов. Об отсутствии более глубоких конформационных изменений казеина, свидетельствует соответствие свободного члена аппроксимирующих уравнений (рис.2) значению этой характеристики для обезжиренного молока.
Обобщая исследования Н+-релаксационных явлений в молочно-крахмальных системах, приходим к следующим выводам. Крахмал иммобилизует воду в молочной среде более активно, чем в водной. Казеин оказывает синергетическое влияние на гелеобразующую способность крахмала. Образующийся комплексный гель представляет собой сетку из спиральных молекул крахмала, в ячейки которой включены мицеллы и субмицеллы казеина, взаимодействующие с положительно заряженными участками спирали и способствующие образованию дополнительных узлов сетки.
СПИСОК ЛИТЕРАТУРЫ:
- Рабек Я. Экспериментальные методы в химии полимеров: ч.I М.: Мир, 1983. С.188-195.
- Захарова Н.П., Соколова Н.Ю., Родин В.В., Измайлова В.Н., Ямпольская Г.П. Изучение состояния воды в сычужных и плавленых сырах методом ЯМР// Мол. пром-сть. 1997. №2. С.35.
- Родин В.В., Измайлова В.Н. Липид-нуклеиновые взаимодействия в дисперсиях фосфолипидных везикул по данным методов ЯМР // Колл. журн. 1995. Т.57. № 2. С.231.
- Rodin V.V., Izmailova V.N. R-approaches on transmitters and conformational transitions in protein-water-hydrocarbon sistem // Proc. work shop on magnetic resonance imaging and spectroscopy of muscle, Liverpool, U.K.1994. Р.1347.
- Усманов Т.И. ЯМР-спектроскопия производных полисахаридов в связи с их молекулярной структурой// Высокомол. соед. 1991. Т. А33.№4. С.691.
- Бови Ф. ЯМР высокого разрешения макромолекул.- М.: Химия. 1977. 456 с.
- Бирштейн Т.М. Синтез, структура и свойства полимеров. Л.:Наука. 1989. 276 с.
- Гросберг А.Ю., Шахнович Е.И. К теории гетерополимеров с замороженной беспорядочной первичной структурой: свойства глобулярного состояния, переходы типа клубок-глобула, возможные биофизические приложения // Биофизика. 1986. Т. 31. № 6. С. 1045.
- Перри С., Амос Р., Брюер П. Практическое руководство по жидкостной хроматографии. М.:Мир. 1974. 260 с.
- Hiroyuki Kanai, Takeshi Amari. Negative thixotropy in ferric-oxide suspensions// Rheologika Acta. 1995. V.3. № 3. Р. 303.



