Однако, как показывает практика, после прекращения сеансов адаптации, сформированный адаптивный защитный след существует относительно недолго, он постепенно «стирается» и после этого наступает дезадаптация. Поэтому для поддержания системного структурнофункционального следа адаптации, обеспечивающего надежную профилактику или целенаправленную коррекцию тех или иных функциональных нарушений у человека необходимо проводить регулярные сеансы адаптации людей к условиям гипоксии. Такой подход становится достаточно трудоемким и поэтому столь эффективный метод коррекции функциональных возможностей организма не нашел должного распространения в клинике.
Согласно ряду исследований [3, 5, 6] в адаптации организма к тем или иным воздействиям существенную роль играют нейротрансмиттерные системы, воздействуя на которые можно пролонгировать, сформированный адаптивный след. Поэтому в настоящей работе исследованы медиаторные механизмы, обеспечивающие адаптивные перестройки в организме. Цель исследования заключалась в изучении состояния моноаминергических (МА-) систем различных отделов мозга после адаптации организма к периодической гипоксии.
Исследования выполнены на стандартных белых крысах-самцах линии Вистар массой 160 -180 г. Концентрацию моноаминов (МА) в структурах ЦНС определяли с помощью метода высокоэффективной жидкостной хроматографии с электрохимической детекцией [1]. Адаптацию животных к гипоксии проводили в барокамере на «высоте» 5000 м в течение 30 суток по 6 часов ежедневно.
Результаты исследований показали, что после месячной адаптации крыс к периодической гипоксии в условиях барокамеры, существенно меняется характер межмедиаторных взаимоотношений в МА-ергических системах различных отделов мозга (рис.).
Установлено, что через сутки после последнего сеанса адаптации в коре головного мозга существенно увеличивается (на 25 %) уровень норадреналина (НА), тогда как концентрация дофамина (ДА) снижается на 30 %. Полученные экспериментальные данные показали, что снижение уровня ДА могло быть обусловлено активацией процессов, обеспечивающих его превращение в НА, при этом концентрация диоксифенилуксусной кислоты (ДОФУК) оказалась статистически достоверно увеличена на 15 % по сравнению с контролем.
Исследования концентраций серотонина (СТ) установили, что адаптация организма к гипоксии сопровождается накоплением СТ в коре головного мозга, превышающем контрольный уровень на 22 %. Определение одного из метаболитов СТ, а именно 5-оксииндолилуксусной кислоты (5-ОИУК), показало, что увеличение концентрации СТ связано со снижением его деградации. Таким образом, полученные результаты свидетельствуют о том, что после адаптации животных к гипоксии в коре головного мозга обнаруживается активация НА- и СТ-ергической систем.
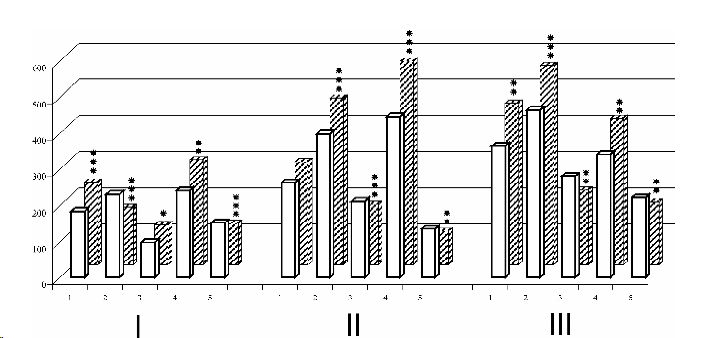
Рисунок 1. Концентрация моноаминов в различных отделах головного мозга животных после адаптации их к гипоксии (в нг/г сырой ткани). 1 - НА; 2 - ДА; 3 -ДОФУК; 4 - СТ; 5 - 5-ОИУК; I - кора; II- средний мозг; III - продолговатый мозг; □ - контроль; ■ - опыт; * - p<0,05; ** - p<0,01; *** -p<0,001.
Для сопоставления уровня медиаторов в коре, где находятся в основном терминали МАергических систем, с отделами мозга, содержащими МА-синтезирующие нейроны, был изучен метаболизм МА в среднем и продолговатом мозге.
Оказалось, что после адаптации концентрация НА в среднем мозге не изменялась, тогда как в продолговатом мозге уровень НА был выше контрольной величины на 24 %. Содержание же ДА в среднем мозге увеличивалось по отношению к контролю на 16 %, что, по-видимому, связано со снижением уровня активности моноаминоксидаз. В пользу этого свидетельствует уменьшение на 20 % одного из метаболитов ДА, а именно ДОФУК.
Как свидетельствуют результаты исследований, адаптация организма к гипоксии приводит к изменению состояния СТ-ергической системы среднего мозга. Так, через сутки после прекращения сеансов адаптации здесь выявлено увеличение концентрации СТ на 27 %. Такие изменения в значительной мере могут быть обусловлены снижением активности ферментативных систем, обеспечивающих превращение СТ в 5ОИУК. В пользу этого свидетельствует снижение концентрации 5-ОИУК в среднем мозге на 30 % после прекращения 30-суточных сеансов адаптации животных в барокамере.
Сопоставление отдельных звеньев метаболизма ДА и НА в среднем и продолговатом мозге обнаружило однотипный характер сдвигов исследованных показателей. Так, у животных, адаптированных к условиям гипоксии, выявлена активация ДА-ергической системы в продолговатом мозге. Концентрация ДА здесь превышала контрольный уровень на 20 %. Однако возможности ДА-синтезирующих структур этого отдела мозга, по-видимому, снижены и накопление запасов ДА в значительной мере связано со снижением активности ферментативных систем, обеспечивающих превращение ДА в ДОФУК и, как следствие, снижение концентрации ДОФУК в среднем мозге. Аналогичный характер сдвигов обнаружен и при исследовании СТ-ергической системы продолговатого мозга. У адаптированных к гипоксии животных содержание СТ увеличивалось на 20 %, при этом содержание 5ОИУК, оказалось статистически достоверно ниже контрольного уровня на 21 %.
Таким образом, проанализировав характер сдвигов в ДА-ергической и СТ-ергической системах среднего и продолговатого мозга у адаптированных к гипоксии животных, можно заключить, что сеансы адаптации активируют эти системы в стволовом отделе мозга. Однако судя по уровню ДОФУК и 5-ОИУК, синтетические возможности ДАи СТ-синтезирующих структур, по-видимому, снижены. Здесь возникает некоторое противоречие между повышенными функциональными потребностями стволовых структур мозга адаптированных животных в дофамине и серотонине и сниженными синтетическими возможностями этих структур мозга. Тогда метаболизм этих МА перестраивается так, что активность процессов деградации ДА и СТ снижается, чтобы сохранить повышенный уровень данных медиаторов, обеспечивающих высокую функциональную активность ДА-и СТ-ергических систем у адаптированных животных.
Исследования показали, что формирование адаптивного следа сопряжено с активацией МАергических систем в исследованных отделах мозга, где после завершения сеансов адаптации выявлено в основном накопление катехоламинов и серотонина. Однако в большинстве случаев оно сопровождалось снижением концентрации продуктов деградации этих МА. Все это свидетельствует о том, что синтетические возможности МА-синтезирующих структур мозга могут быть фактором, лимитирующим адаптивные возможности организма.
СПИСОК ЛИТЕРАТУРЫ
- Бауэр Г., Энгельгард Х., Хеншен А. и др. Высокоэффективная жидкостная хроматография в биохимии. М.: Мир. 1988. 688 с.
- Караш Ю.М., Стрелков Р.Б., Чижов А.Я. Нормобарическая гипоксия в лечении, профилактике и реабилитации. М.: Медицина. 1988. 357с.
- Мамалыга Л.М., Мамалыга М.Л. Роль биогенных аминов в проявлении структурнометаболических сдвигов в ЦНС при стрессе, адаптации и функциональных нарушениях. М. 2004. Изд-во «Прометей». 363 с.
- Меерсон Ф.З., Твердохлеб В.П., Боев В.М., Фролов Б.А. Адаптация к периодической гипоксии в терапии и профилактике. М.: Наука. 1989. 70 с.
- Хайдарлиц С.Х. Нейромедиаторные механизмы адаптации. Кишинев: «Штиинца». 1990.179 с.
- Kvetnansky R., Tilders F. //Endocrinology.1987. V. 45. № 4. P. 318.



