Ферменты - высокоспециализированный класс веществ белковой природы, которые используются живыми организмами для проведения тысяч взаимосвязанных реакций, включая взаимопревращение большого числа различных химических соединений. Энзимология играет большую роль в решении множества проблем биохимии и молекулярной биологии. Генетическая система посредством ферментов контролирует направления, по которым протекают биохимические реакции. Гены действуют через ферменты. В связи с этим одним из направлений развития генетики сельскохозяйственных животных является выявление генных систем, которые определяют ферментные связи и через них влияют на метаболизм и продуктивность животных. Активность одних ферментов зависит от структуры белка, для других необходимо присутствие простетической группы. Ионы отдельных металлов могут входить в состав коферментов [5].
В состав активного центра каталазы (К.Ф.1.1.1.16) входит железо, меняющее свою валентность в процессе катализируемой реакций.
Каталаза относится к классу оксидоредуктаз, участвует в окислительно-восстановительных процессах, катализирует конечные окислительные реакции, связанные с присоединением кислорода. Роль каталазы значительна в том, что она расщепляет токсичные для организма пероксиды водорода и высшие пероксиды на воду и кислород.
МЕТОДИКА ИССЛЕДОВАНИЙ
Эксперимент поставлен в учебно-опытном хозяйстве «Тулинское» при Новосибирском аграрном университете. В качестве объекта для исследования были свиньи пород крупной белой (группа 1, контрольная), кемеровской (группа II) и ландрас (группа III). Экспериментальные группы формировали по принципу аналогов, с учетом происхождения, породности, возраста, живой массы. Исследована активность каталазы [1] в митохондриях, супернатанте печени и сердца свиней. Пробы тканей брали во время контрольного убоя у шести животных из каждой группы. Методом дифференциального центрифугирования изолировали митохондрии из 10% гомогената в 0,25М растворе сахарозы. Чистоту митохондриальной фракции проверяли в фазовом контрасте. Для исследования брали количество митохондрий, соответствующее 0,1-0,2 мг митохондриального белка. Белок определяли с использованием бычьего сывороточного альбумина в качестве стандарта [4]. Полученные материалы обработаны статистически на PC Intel Celeron 1.3GHz.
Межпородные различия были отражены по активности каталазы в митохондриях сердца и печени свиней (таблица). Значительное увеличение каталазной активности наблюдалось в митохондриальной фракции сердца свиней кемеровской породы по сравнению с животными крупной белой (11,06 %, р < 0,05). Наблюдалось повышение уровня энзиматической активности в митохондриях сердца свиней породы Ландрас.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Таблица. Активность каталазы (мг Н2О2/мг белка) в митохондриях, супернатанте печени и сердца свиней
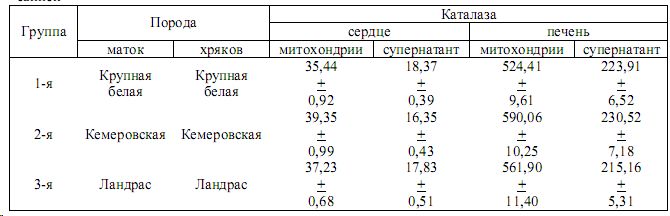
Исследование ферментативной активности в митохондриальной фракции печени у подсвинков кемеровской породы показало достоверное нарастание ее относительно контроля (12,52 %, р< 0,05). Обнаружено, что активность изучаемого фермента в печеночных митохондриях у ландрасов была несколько ниже, чем у молодняка кемеровской породы.
Изучение активности каталазы в супернатанте сердца молодняка экспериментальных групп выявило волнообразный характер изменений (таблица). Максимальная каталазная активность установлена у свиней крупной белой породы. Некоторое уменьшение энзиматической активности отмечено в супернатанте сердца животных кемеровской породы по сравнению с контролем, которое сменялось повышением ее у ландрасов.
Выявлена тенденция к нарастанию ферментативной активности в супернатанте печени у подсвинков кемеровской породы относительно крупной белой. У молодняка ландрасов активность изучаемого фермента была ниже, чем у свиней кемеровской породы и крупной белой.
В эксперименте установлены межпородные различия по активности каталазы в митохондриях и супернатанте различных органов свиней. Обнаружено активирование фермента в митохондриальной фракции сердца и печени у животных кемеровской породы по сравнению со сверстниками крупной белой породы и ландрас. Вероятно это связано с усилением окислительновосстановительных процессов и повышением энергетического обмена у подсвинков кемеровской породы [2].
Литература
- Бах А.Н., Зубкова С.Р. Собрание трудов по химии и биохимии.-М., 1950.537с.
- Холоденко Б.Н. Современная теория контроля метаболизма. -М.: ВИНИТИ, 1991.90с.
- Hulst M.M. et al. Virology. Orlando, Fla.: Academic Press.-1994.-V.200 (2). -P.558.
- Lowry O. et al. // J. Biol. Chem.-1951.V.193.№1.P. 265.
- Radesci S.V. et al. //J. Anim. Sci.-1992.V.24.P. 305.



