В последние годы наметилась тенденция к росту заболеваемости сальмонеллезом, особенно у детей в возрасте до 14 лет, при этом продолжает доминировать S. еnteritidis, растет доля антибиотикорезистентных штаммов [1].
Несмотря на постоянно увеличивающееся число антимикробных препаратов (АМП) на рынке, эффективность антибактериальной терапии (АБТ) неуклонно снижается и на сегодняшний день может расцениваться как критическое. В этой связи ВОЗ в 2001 году разработала «Глобальную стратегию ВОЗ по сдерживанию антибиотикорезистентности». При этом речь идёт не только о необходимости пропаганды и быстрейшего внедрения в практику новых АМП. Очень важным представляется раннее выявление неблагоприятных тенденций, и разработка мер, направленных на «продление жизни» известных препаратов [2].
Исходя из определения антибиотикочувствительности штаммов S. еnteritidis и S. typhimurium, можно повысить эффективность и безопасность лечения.
Все вышеизложенное и послужило необходимостью для формирования цели исследования.
Цель исследования – оценка клинической эффективности антибиотикотерапии с определением чувствительности к антимикробным препаратам клинических штаммов S. entiriditis и S.typhimurium, выделенных у обследуемых детей.
Материалы и методы исследования
Под клиническим наблюдением находились 129 больных в возрасте от 1 месяца до 14 лет, находившихся на стационарном лечении в профильном кишечном отделении, а также в отделении реанимации и интенсивной терапии Областной инфекционной больницы (ОИБ) по поводу сальмонеллеза еnteritidis и typhimurium.
Верификацию диагноза «сальмонеллез» осуществляли бактериологическим методом. Клиническое обследование больных проводилось по общепринятой методике с заполнением специально разработанной карты, которая включала в себя данные тщательно собранного анамнеза, объективного обследования больных и лабораторных методов [3]. На основании клинико-эпидемиологических, микробиологических исследований у 68 (52,7 %) детей был диагностирован сальмонеллез еnteritidis, а у 61 (47,3 %) – сальмонеллез typhimurium.
Результаты исследования и их обсуждение
Важным условием достижения клинической эффективности антимикробной терапии является создание высоких концентраций антибиотика в сыворотке крови больного на протяжении длительного времени. При этом фармакокинетические характеристики антимикробного препарата будут определять режим применения препарата: кратность и пути введения, а МПК (минимальная подавляющая концентрация) и период полувыведения – дозировку препарата.
Обоснованием для назначения препарата была клиническая антибиотикограмма.
Изучение эффективности in vitro антимикробной терапии сальмонеллеза, вызванного S.enteritidis, выявило высокую эффективность, что подтверждалось клиническими данными.
В результате микробиологического исследования выделенная культура S.enteritidis, была чувствительна к цефалоспоринам II–IV поколения, антимикробным препаратам группы аминогликозидов и фторированных хинолонов. В качестве базового препарата этиотропной антимикробной терапии выбран цефтриаксон (клафоран) в дозировке 50–75 мг/кг/сутки внутривенно. Учитывая длительный период полувыведения, выбран интервал введения препарата 12 часов. Результаты исследования клинической эффективности in vitro представлены на рис. 1.
Анализ динамики роста in vitro в контрольной лунке (рис. 1, образец ЭК), выявил быстрое нарастание микробной биомассы по логарифмическому закону:
y = 613,66∙ln(x) – 767,04, (1)
c коэффициентом аппроксимации R2 = 0,9439.
Проба сыворотки крови, содержащая максимальную концентрацию антибиотика (Э +), обладала высокой антимикробной активностью, что обеспечивало подавление роста микроорганизмов на протяжении всего периода мониторирования, в то время, как проба сыворотки крови, взятая перед следующим введением препарата (Э-), проявляла больше статический эффект, который сохранялся на протяжении 1,5 часов, после чего также наблюдался статистически значимый прирост оптической плотности.
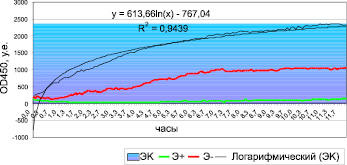
Рис. 1. Динамика микробного роста на сыворотке крови больного in vitro:ЭК – контроль (сыворотка крови без антибиотика); Э+ – сыворотка крови больного после парентерального введения антибиотика; Э– – сыворотка крови больного перед следующим введением антибиотика
У больных с сальмонеллезом еnteritidis в клинической картине на 5-й день лечения температура тела снизилась до субфебрильных цифр, появился аппетит, улучшился эмоциональный тонус, купировались симптомы токсикоза с эксикозом III степени, гиповолемического шока III степени, нейротоксикоза, но частота стула оставалась до 3–5 раз в сутки без патологических примесей.
Таким образом, нашими исследованиями была определена и доказана позитивная клинико-лабораторная динамика на фоне применения цефалоспорина III поколения (клафорана), обладающего широким спектром антибактериального действия и оказывающего бактерицидное действие на грамотрицательные микроорганизмы – сальмонеллы. Клафоран устойчив к действию большинства бета-лактамаз, нами определена его клиническая эффективность в терапии тяжелых форм сальмонеллеза еnteritidis.
Выбор препарата для проведения антимикробной терапии S.typhimurium-опосредованного сальмонеллеза, помимо полирезистентности микроорганизмов, имел дополнительные сложности, связанные с выбором дозировки и режима введения.
Картина динамики роста культуры в контроле (рис. 2), как и в случае S.enteritidis, подчинялась логарифмическому закону:
y = 391,3ln(x) – 440,67, (2)
что подтверждается высокими значениями коэффициента аппроксимации R2 = 0,93. Решение уравнения (2) выявило пролонгирование темпов роста, что косвенно может свидетельствовать о снижении уровня энергетического метаболизма в клетках [4] и как следствие – снижение проницаемости клеточных стенок [5]. Учитывая фоновую полирезистентность культур, представлялось затруднительным выбрать препарат этиотропной терапии. Гиперэкспрессия плазмидных генов БЛРС и ассоциированных с ними генов продукции АГМФ практически исключала препараты этих групп из списка выбора. В то же время применение фторхинолонов также нуждалось в весомом обосновании [6]. Кроме того, высокая встречаемость резистентность к налидиксовой кислоте, не позволяла рекомендовать [7] группу фторированных хинолонов к широкому применению.
Мониторирование клинической эффективности монотерапии сальмонеллеза, вызванного S.typhimurium, ципрофлоксацином не позволило получить высокую эффективность, несмотря на низкие значения МПК (средние значения МПК составили 1,22 мкг/мл). По всей вероятности, наличие терапевтических концентраций ципрофлоксацина приводило к экспрессии генов gyr A, B, что способствовало быстрому нарастанию МПК и, как следствие – снижению клинической эффективности (рис. 2).
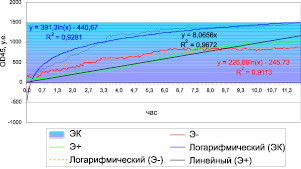
Рис. 2. Динамика микробного роста на сыворотке крови больного in vitro. Больной Д. (ист.бол. № 4099):ЭК – контроль (сыворотка крови без антибиотика); Э+ – сыворотка крови больного после парентерального введения антибиотика; Э– – сыворотка крови больного перед следующим введением антибиотика
При проведении микробиологического исследования культура S. typhimurium, являющаяся продуцентом БЛРС и характеризующаяся устойчивостью к гентамицину, тобрамицину, нетилмицину, доксициклину и налидиксовой кислоте, проявляла чувствительность in vitro к ципрофлоксацину. С учетом чувствительности внутрибольничного штамма сальмонеллы typhimurium, по жизненно важным показаниям в качестве базового препарата этиотропной антимикробной терапии использовали ципрофлоксацин в дозе 30 мг/кг/сутки внутривенно. Учитывая длительный период полувыведения, выбран интервал введения препарата 12 часов.
Результаты исследования клинической эффективности in vitro представлены на рис. 2.
При моделировании динамики роста в присутствии сыворотки больного с максимально достижимой дозой ципрофлоксацина (см. рис. 2), количество микроорганизмов достоверно не менялось на протяжении 55 минут (фаза адаптации), после чего достоверно нарастало на протяжении всего периода мониторирования, что описывалось математической моделью линейного уравнения:
y = 8,0656x, (3)
с коэффициентом аппроксимации R2 = 0,97.
Динамика роста микробной популяции в присутствии сыворотки крови больного, взятой перед следующим введением препарата (минимальная терапевтическая сывороточная концентрация препарата), характеризовалась достоверным приростом оптической плотности на протяжении всего периода мониторирования и писывалась математической моделью на основе логарифмического уравнения:
y = 226,66ln(x) – 245,73, (4)
при коэффициенте аппроксимации R2 = 0,91.
Таким образом, полученная картина, очевидно, демонстрировала необходимость коррекции применяемой схемы антимикробной терапии.
Антибактериальное лечение тяжелых форм внутрибольничного сальмонеллеза typhimurium, наряду с парентеральным введением в монорежиме, требует адекватной комбинации с другими антибиотиками.
Отсутствие эффекта при лечении сальмонеллеза у детей известными антибактериальными препаратами обуславливает постоянный поиск новых антимикробных препаратов, способных подавлять рост и развитие сальмонелл. Однако ряд микроорганизмов, в том числе и внутрибольничный штамм сальмонелл, не чувствительны ко многим антибактериальным препаратам.
В соответствии с поставленной целью и задачами настоящего исследования при терапии тяжелой формы внутрибольничного сальмонеллеза typhimurium нами проведено определение чувствительности и расшифрованы механизмы устойчивости, что послужило основанием для коррекции лечения с использованием комбинации препаратов – ципрофлоксацин + меронем (меропенем). При комбинированном назначении ципрофлоксацин вводили через рот в дозе 30 мг/кг/сутки. Принимая во внимание длительный период полувыведения, выбран интервал введения препарата 12 часов. Меронем (меропенем) назначали из расчета 20 мг/кг в сутки внутривенно 3 раза. Выбран интервал введения препарата через 8 часов – с учетом длительности периода полувыведения.
Оценку терапевтической эффективности препарата проводили по клиническим критериям. При тяжелой форме внутрибольничного сальмонеллеза typhimurium исследованы 2 группы: 1 группа – 10 детей, которые получали ципрофлоксацин в монорежиме, 2 группа – 25 детей получали в комплексной терапии меронем (меропенем).
Бактериологическая эффективность антибактериальных препаратов оценивалась по случаям зарегистрированного повторного бактериовыделения. В группе с использованием ципрофлоксацина в монорежиме повторное бактериовыделение наблюдалось у 8 больных (80,0 %). В группе с использованием комбинированной терапии бактериологическая эффективность зарегистрирована у 23 (92,0 %) больных.
Недостатком монотерапии являются длительность купирования клинических симптомов и повторное бактериовыделение.
Нашими исследованиями была определена и доказана позитивная клиническая динамика на фоне применения комбинации фторхинолона – ципрофлоксацина и карбапенема – меронема, обладающего широким спектром антибактериального действия и оказывающего бактерицидное действие на грамотрицательные микроорганизмы. Меронем устойчив к действию большинства β-лактамаз. Нами определена его клиническая эффективность при комбинировании с ципрофлоксацином в терапии тяжелых форм внутрибольничного сальмонеллеза.
При тяжелой форме внутрибольничного сальмонеллеза нами были проведены коррекции путем проведения комбинированной терапии с использованием препаратов – ципрофлоксацин + меронем (меропенем), благодаря которым в первые сутки болезни обеспечивалась максимальная концентрация препаратов в крови, что препятствовало генерализации инфекции.
Карбапенемы имеет структурное сходство с другими β-лактамными антибиотиками, но в отличие от них характеризуются более высокой устойчивостью к действию БЛРС и более широким спектром активности.
В группу карбапенемов входят имипенем и меропенем, действующие на многие штаммы грамотрицательных бактерий, устойчивых к цефалоспоринам III и IV поколения. Показаниями являются тяжелые инфекции, в том числе нозокомиальные, вызванные полирезистентными микроорганизмами. Меропенем оказывает бактерицидное действие за счет воздействия на синтез клеточной стенки бактерий. Мощное бактерицидное действие меропенема против широкого спектра аэробных и анаэробных бактерий объясняется высокой способностью меропенема проникать через клеточную стенку бактерий, высоким уровнем стабильности к большинству β-лактамаз и значительной аффинностью к белкам, связывающим пенициллин (БСП). Минимальные бактерицидные концентрации (МБК) обычно такие же, как и минимальные ингибирующие концентрации (МИК). Для 76 % протестированных видов бактерий соотношение МБК/МИК было 2 или меньше.
Меропенем стабилен в тестах определения чувствительности возбудителя. Тесты in vitro показывают, что меропенем действует синергидно с различными антибиотиками. В тестах in vitro и in vivo показано, что меропенем обладает постантибиотическим эффектом.
В нашем наблюдении не выявлено ни одного случая устойчивости к карбапенемам, что на фоне массивной БЛРС-продукции изученными штаммами делает группу карбапенемов единственной с потенциально ожидаемой клинической эффектвностью среди бета-лактамных антибиотиков.
Сальмонеллы относятся к инфекциям с внутриклеточной локализацией. Внутриклеточное паразитирование сальмонелл в эпителиоцитах кишечника (в том числе и макрофагах) создает возможность их длительного персистирования в организме, возникновения обострений и рецидивов, а также формирование длительного бактериовыделения и низкую эффективность санирующего эффекта от антибиотикотерапии.
Как известно, антибиотики, обладая «цидным» или «статическим» действием, приостанавливают размножение или вызывают гибель микроорганизмов. Поэтому весьма важным в механизме действия антибактериальных препаратов является воздействие их не только на сальмонеллы, находящиеся в просвете кишечника, но и на тех, которые локализованы внутри клетки. В этом плане широким антибактериальным спектром с преимущественной активностью в отношении грамотрицательных бактерий обладают фторхинолоны. Наряду с ингибированием двух жизненно важных ферментов микробной клетки, ДНК-гидразы и IV-топоизомеразы, они обладают способностью проникать внутрь клетки, что является дополнительным фактором механизма действия в отношении микроорганизмов с внутриклеточной локализацией. Ингибирование функции ДНК-гидразы приводит к необратимым изменениям в клетке и в итоге – к ее гибели, то есть к бактерицидному эффекту. Фторхинолоны, по мнению Падейской Е.Н. (1997), подавляя биосинтез ДНК в микробной клетке, не влияют на биосинтез ДНК в клетках макроорганизма. Фторхинолоны активны в отношении штаммов бактерий, устойчивых к препаратам других классов химиотерапевтических средств, а также в отношении большинства штаммов, устойчивых к нефторированным хинолонам.
Ципрофлоксацин обладает бактерицидным типом действия, причем бактерицидные концентрации равны или, как правило, существенно не превышают бактериостатические. Глубокие повреждения структуры и функции микробной клетки даже при действии субингибирующих концентраций, подавление клеткой экзоферментов, токсинов, снижение вирулентных свойств штаммов существенно повышают фагоцитарную активность в отношении поврежденных клеток. Для ципрофлоксацина характерен длительный постантибиотический эффект, особенно после воздействия бактерицидных концентраций. Кроме того, он хорошо сочетается практически со всеми другими группами антимикробных препаратов и способен хорошо проникать в органы, ткани и биологические жидкости.
Таким образом, для повышения эффективности проводимой терапии тяжелых форм внутрибольничного сальмонеллеза мы рекомендуем комбинацию препаратов – ципрофлоксацин + меронем (меропенем).
Выводы
1. Нашими исследованиями была определена и доказана позитивная клинико-лабораторная динамика на фоне применения цефалоспорина III поколения (клафорана), обладающего широким спектром антибактериального действия и оказывающего бактерицидное действие на грамотрицательные микроорганизмы – сальмонеллы. Клафоран устойчив к действию большинства бета-лактамаз, нами определена его клиническая эффективность в терапии тяжелых форм сальмонеллеза еnteritidis.
2. Мониторирование клинической эффективности монотерапии сальмонеллезов, вызванных S.typhimurium, с помощью ципрофлоксацина не позволило получить высокую эффективность, несмотря на низкие значения МПК (средние значения МПК составили 1,22 мкг/мл). По всей вероятности, наличие терапевтических концентраций ципрофлоксацина приводило к экспрессии генов gyrA, B, что способствовало быстрому нарастанию МПК и, как следствие, – снижению клинической эффективности, что демонстрировала необходимость коррекции применяемой схемы антимикробной терапии.
3. В последующем в проводимой антимикробной терапии были проведены коррекции путем использования комбинации препаратов – ципрофлоксацин + меронем (меропенем).



