Разработка, научное обоснование и экспериментально-морфологическая апробация применения биоматериалов с хондропластической эффективностью – одна из наиболее актуальных проблем современной ортопедии и травматологии [1]. Наиболее часто используемыми имплантационными материалами в настоящее время являются: деминерализованный костный матрикс, матрицы из полимолочных и полигликолевых кислот, коллагеновые криогели, стеклокристаллические материалы, аналоги костного минерала, полисахариды природного происхождения [8]. Недостатками этих имплантатов являются: сложность изготовления, низкая пластическая эффективность, отсутствие хондрогенной активности, ограниченная биосовместимость. При их получении используют термическую обработку и деминерализующие вещества, что отрицательно сказывается на клинических результатах [1, 7].
Цель работы – морфологический анализ репаративного хондрогенеза при имплантации в зону повреждения коленного сустава минерального компонента костного матрикса (МККМ), полученного по оригинальной технологии без применения термической и деминерализующей обработки [4].
Материал и методы исследования
Эксперименты выполнены на 20 половозрелых крысах линии Wistar массой 340–390 г в условиях операционной с применением общей анестезии (рометар 8 мг и золетил 4 мг на 1000 г массы тела внутримышечно). Использовали также 5 интактных животных. Содержание, эксперименты и эвтаназию животных выполняли в соответствии с нормативными документами [2]. На пателлярной поверхности дистального конца левой и правой бедренной кости зубным бором моделировали несквозные окончатые дефекты диаметром 2,5–3 мм до проникновения в субхондральную кость. В область дефекта правой кости вводили гранулированный МККМ массой 2–3 мг, зону дефекта левой кости не подвергали никакому воздействию и использовали в качестве контроля. МККМ получали из аллогенных трубчатых костей с последующим измельчением до порошкообразного состояния [4]. Через 7, 15, 30 и 60 суток после операции животных выводили из эксперимента (использовали по 5 животных на каждый срок). Бедренные кости фиксировали в 2 % растворе параформальдегида и глутаральдегида и заливали в парафин (после декальцинации) и в аралдит (без декальцинации). Парафиновые срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону и альциановым синим при рН 2,5 и 1,0. Концентрацию альцианового синего, отражающую содержание гликозаминогликанов, и химический (элементный) состав МККМ определяли при помощи энергодисперсионного рентгеновского спектрометра (рентгеновского электронно-зондового микроанализатора) INCA-200 Energy (Oxford instruments, Англия) [5]. Структуру МККМ и регенератов исследовали с помощью сканирующего электронного микроскопа JSM-840 (Jeol, Япония). Результаты количественных исследований обрабатывали методами вариационной статистики. Достоверность различий сравниваемых параметров рассчитывали с использованием критерия Стьюдента. Различия считали значимыми при уровне значимости Р < 0,05.
Результаты исследования и их обсуждение
Имплантируемые гранулы МККМ имеют размер 50–200 мкм в поперечнике и упорядоченную высокопористую структуру, строение их поверхности характеризуется резко выраженной шероховатостью и фрактальностью с размером зерна в нанодиапазоне. Они обладают множеством взаимосвязанных макро- и микропор неправильной формы размером 10–20 мкм, некоторые из которых имеют размеры менее 100 нм. Поры соответствуют местам локализации остеоцитарных лакун и костных канальцев, из которых клетки и другие органические компоненты были удалены при получении имплантата (рис. 1).


Рис. 1. Гранулы МККМ. Сканирующая электронная микроскопия
Микроархитектоника гранул МККМ близка к естественной архитектонике костного матрикса. Химический состав МККМ (табл. 1) соответствует минеральному составу коркового слоя диафиза большеберцовой кости интактных взрослых крыс [3].
Таблица 1
Содержание элементов в составе имплантируемых гранул МККМ (%, М ± m)
|
Химические элементы |
Натрий |
Магний |
Фосфор |
Сера |
Кальций |
|
Массовые проценты |
0,44 ± 0,02 |
0,35 ± 0,01 |
13,59 ± 0,65 |
0,28 ± 0,01 |
26,76 ± 1,33 |
Величина коэффицента Са/Р, отражающая качественный состав апатита в гранулах МККМ, составляет 1,97 ± 0,11, что меньше чем у кристаллического гидроксилапатита. Это свидетельствует, по литературным данным [8, 9], о том, что МККМ не является аналогом стехиометрического гидроксилапатита – Са10[РО4]6[OH]2, а представляет собой даллит – карбоксигидроксилапатит – Са5[РО4]∙[СO3]3ОН с лабильной структурой поверхностного слоя аморфного карбонатапатита, обладающего более выраженной, по сравнению с натуральной костью, интенсивностью обмена ионов.
Проведенные исследования показали, что через 7 суток после операции в левой и правой конечности суставная капсула гиперемирована и отечна. Хрящевое покрытие приобретает матовый оттенок. В зоне повреждения выявляются признаки воспалительной реакции и альтеративно-деструктивные преобразования, затрагивающие все компоненты метаэпифиза. Обнаруживаются очаги организованной гематомы, инфильтрированной сгустками фибрина, малодифференцированными клеточными элементами, нейтрофильными гранулоцитами, макрофагами, тучными клетками, экстравазальными эритроцитами и лимфоцитами. Выявляются лейкоцитарно-некротические массы, содержащие лизированные клетки и пласты фибрина. Суставной хрящ скарифицирован. Зона дефекта частично восполняется грануляционной и малодифференцированной рыхлой соединительной тканью с признаками отека и немногочисленными сосудами. В правой (опытной) кости в зоне повреждения субхондральной кости наблюдаются единичные костно-остеоидные очаги репаративного костеобразования по типу интрамембраного остеогенеза и единичные тонкие трабекулы. Достоверных отличий в содержании гликозаминогликанов в зоне повреждения суставного хряща на этом этапе эксперимента в контроле и опыте не выявлено (табл. 2).
Таблица 2
Содержание гиалуроновой кислоты и сульфатированных гликозаминогликанов в зоне повреждения суставного хряща (у.е., М ± m)
|
Период исследования, сутки |
До операции |
7 |
15 |
30 |
60 |
|
Контроль: гиалуроновая кислота сульфатированные гликозаминогликаны |
0,59 ± 0,03 0,68 ± 0,03 |
0,18 ± 0,01 0,11 ± 0,01 |
0,19 ± 0,01 0,12 ± 0,01 |
0,21 ± 0,01 0,16 ± 0,01 |
0,22 ± 0,01 0,24 ± 0,01 |
|
Опыт: гиалуроновая кислота сульфатированные гликозаминогликаны |
0,58 ± 0,03 0,69 ± 0,03 |
0,20 ± 0,01 0,12 ± 0,01 |
0,49 ± 0,01* 0,26 ± 0,01* |
0,56 ± 0,02* 0,54 ± 0,01* |
0,59 ± 0,03* 0,70 ± 0,01* |
Примечание. * – достоверные отличия по сравнению с контрольными показателями.
Через 15 суток после операции в контрольной кости в центральной зоне дефекта выявляются многочисленные лейкоциты, фибробластические элементы, пучки коллагеновых волокон, грануляционная ткань и значительное количество расширенных и заполненных кровью сосудов. В правой (опытной) кости клеточно-волокнистые элементы воспаления не выявляются, репаративное костеобразование происходит не только по типу интрамембраного, но и энхондрального остеогенеза. В зоне повреждения субхондральной кости формируется обширная мелкопетлистая сеть утолщенных трабекул, покрытых рядами многочисленных крупных остеобластов, образующих губчатую кость, тесно спаянную с поверхностью подлежащей кости. Вокруг и внутри имплантируемых гранул МККМ, имеющих вид кистозных полостей, которые образовались вследствие биодеструкции и декальцинации образца, располагаются фукционально активные остеокласты с многочисленными ядрам и щеточной каемкой (рис. 2).
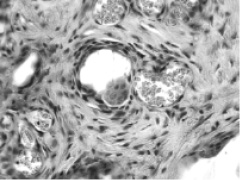
Рис. 2. Зона дефекта суставного хряща. 15 суток после операции. Остеокласт внутри имплантируемой гранулы МККМ. Многочисленные синусоиды окружены пролиферирующими периваскуляроцитами. Гематоксилин-эозин. Объектив 40, окуляр 10
В этих участках отсутствуют геморрагии и очаги деструкции, отмечается активная пролиферация фибробластов, интенсивный неоангиогенез, на поверхности гранул располагаются слои остео-хондрогенных клеток на различных этапах дифференцировки. Зона дефекта суставного хряща частично заполнятся новообразованным гиалиновым хрящом, межклеточное вещество которого содержит преимущественно несульфатированные гликозаминогликаны (табл. 2) и сливается с краями «материнского» суставного хряща, где выявляются клеточные гнезда с изогенными группами. Наличие последних свидетельствует о пролиферативной активности части хондроцитов, являющихся одним из источников хрящевой ткани, заполняющей дефект. Вторым источником являются хондроциты, располагающиеся вокруг гранул МККМ и третьим – хондроциты в зоне энхондрального остеогенеза при заживлении перелома субхондральной кости. Концентрация гликозаминогликанов в зоне дефекта в опыте более чем в 2 раза превосходит контрольные значения (табл. 2). Свойства хондро- и остеоиндуктора имплантационным гранулам МККМ обеспечивают локализованные в них факторы роста и костные морфогенетические белки, которые располагаются в минерализованном матриксе костной ткани и выделяются при остеокластической резорбции [1, 8].
Через 30 и 60 суток после операции в контрольной кости значительный объем зоны дефекта заполнен рыхлой или плотной соединительной тканью (рис. 3, 4). Новообразованная хрящевая ткань формируется лишь в области субхондральной кости в результате ее повреждения и лентовидными структурами отрастает от краев дефекта. В опытной кости дефект суставного хряща почти полностью заполнен новообразованным гиалиновым хрящом с гладкой поверхностью, который отрастает не только от субхондральной кости, но и главным образом от краев дефекта, где располагаются клеточные гнезда, свидетельствующие о пролиферативной активности хондроцитов.
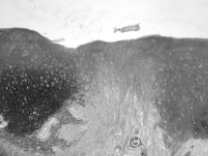
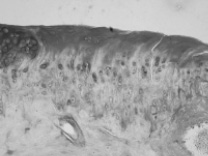
Рис. 3. Зона дефекта суставного хряща. 30 суток после операции. Слева – контроль, справа – опыт. Альциановый синий, рН 2,5. Объектив: слева – 10, справа – 20, окуляр 10
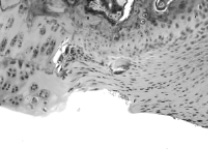
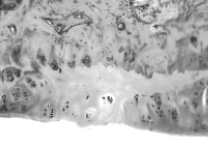
Рис. 4. Зона дефекта суставного хряща коленного сустава. 60 суток после операции. Слева – контроль, справа – опыт. Гематоксилин-эозин. Объектив 20, окуляр 10
Поверхность новообразованного гиалинового хряща приобретает свойственный суставному хрящу интактных животных блеск. Клеточная популяция хрящевого регенерата представлена дифференцированными и пролиферирующими формами хондроцитов с преобладанием последних. Строение регенерата еще не имеет характерной для суставного хряща специфичности. Содержание не сульфатированных и сульфатированных форм гликозаминогликанов через 30 суток после операции в дефекте опытной кости более чем в 2 раза превосходит контрольные показатели, но между собой достоверно не отличается, тогда как через 60 суток сульфатированные формы преобладают, что свидетельствует о более высокой степени зрелости новообразованной хрящевой ткани (табл. 2), приближающейся к степени зрелости, свойственной суставному хрящу интактных животных. Клинические наблюдения показали, что в этот период сгибание и разгибание коленного сустава опытной конечности происходили в полном объеме.
Заключение
Установлено, что гранулы МККМ при имплантации в зону дефекта суставного хряща коленного сустава выявляются на всех сроках последующего наблюдения, оказывают выраженное хондромодулирующее действие, пролонгировано активизируют репаративный хондро- и остеогенез. В зоне повреждения суставного хряща в ранние сроки формируется регенерат, приобретающий клеточную специфику гиалиновой хрящевой ткани, образуется целостное хрящевое покрытие, постепенно выравниваются нарушенные контуры суставной поверхности, что приводит к полному или частичному восстановлению функциональной активности сустава. Таким образом, применение имплантата из МККМ в качестве стимулятора хондро- и остеогенеза представляется теоретически обоснованным и перспективным для коррекции деструктивных нарушений в хрящевой и костной тканях.



