Установлено, что аспирин (Аsp) и его комплексные производные – ацетилсалицилаты кобальта (АСК) и цинка (АСЦ) способны изменять электрические потенциалы нейронов ЦНС [1, 2]. Ранее нами было показано [6], что нейротропное действие салицилатов может реализовываться с участием циклических нуклеотидов (цАМФ и цГМФ), а роль других вторичных посредников в его механизме ещё не ясна. Есть лишь сведения о том, что Аsp и его производные угнетают синтез аденозинтрифосфата (АТФ) [3], однако это явление не связывают с нейротропными эффектами салицилатов. Известно, что в нейронах АТФ используется для работы ионных насосов и каналов и способен дефосфорилироваться до цАМФ – мессенджера аденилатциклазного каскада передачи сигналов внутрь клетки и агониста P2-рецепторов ионных каналов, а продукт его распада – аденозин – регулирует деятельность P1–рецепторов [4, 12]. Вышеизложенное позволяет предположить, что механизм нейротропного действия Аsp и его производных может в значительной степени определяться изменением вне- и внутриклеточной концентрации АТФ. Обращает внимание и отсутствие в литературе данных о роли Са2+ в эффектах салицилатов, хотя известно, что эти ионы могут влиять на возбудимость нейронов и внутриклеточные процессы в них, в том числе и связанные с циклическими нуклеотидами [11].
Таким образом, целью этой работы явилось изучение роли АТФ-зависимых и кальциевых механизмов в реализации нейротропного действия Аsp и его производных – АСК и АСЦ.
Материалы и методы исследования
Исследования проведены на 159 неидентифицированных нейронах висцерального и правого париетального ганглиев улитки Helix albescens Rossm. Для этого окологлоточное нервное кольцо препарировали из тела улитки, фиксировали в экспериментальной камере (объём 0,5 мл) с постоянным протоком раствора Рингера для холоднокровных животных (NaCl – 100, KCl – 4, CaCl2 – 10, MgCl2 – 4, трис-HCl – 10, состав указан в миллимолях на 1 л; температура 18–21 °С, pH = 7,5) и удаляли наружные соединительнотканные оболочки [6, 9]. Затем проток раствора Рингера перекрывали и однократно апплицировали в объёме 1 мл разведённые им до необходимых концентраций вещества. В эксперименте использовали Аsp, BaCl2, CdCl2 («Merk», Германия), АТФ («Здоровье народа», Украина), АСК, АСЦ (синтезированы на кафедре общей химии Таврического национального университета им. В.И. Вернадского) с химической чистотой не менее 95 %. Электрические потенциалы нейронов регистрировали и записывали методом внутриклеточного отведения с помощью физиологической установки [6] и программы «Action Potential» [10] по схеме: фон (1 мин); экспозиция раствора тестируемого вещества – контроль (4 мин.); экспозиция того же вещества (4 мин) в сочетании с одним из агентов (АТФ, CdCl2, BaCl2); отмывание (20 мин). С помощью указанной программы рассчитывали амплитудно-временные характеристики потенциалов нейронов и оценивали скорость нарастания суммарных трансмембранных ионных токов [6]. Статистическую обработку результатов осуществляли с помощью критерия Вилкоксона.
Результаты исследования и их обсуждение
Нейротропные эффекты индивидуальных и сочетанных с аденозинтрифосфатом растворов аспирина, ацетилсалицилатов кобальта и цинка. В данной серии экспериментов были исследованы эффекты индивидуального и сочетанного с АТФ приложения во внеклеточную среду растворов Аsp, АСК, АСЦ. Концентрация каждого вещества в окружающем нейроны растворе составляла 5∙10–4 M. Такая концентрация является физиологической внутри клеток для АТФ [12], и именно в ней Аsp, АСК и АСЦ оказывают выраженное нейротропное действие [1, 2].
Приложение к наружной поверхности мембран нейронов (n = 8) индивидуального раствора АТФ в концентрации 5∙10–4 M не оказывало достоверного влияния на исследуемые параметры их электрической активности. В данном случае отсутствие эффектов объясняется тем, что дополнительные поступления АТФ разрушаются ферментами экто-АТФазами до аденозина [12].
Экспозиция индивидуального раствора Аsp (n = 11) в концентрации 5∙10–4 M приводила к характерному угнетению электрической активности нейронов: снижала частоту генерации импульсов (ЧГИ), уменьшала амплитуду потенциалов действия (ПД) и увеличивала негативность мембранного потенциала (МП) (рис. 1, а, 1–2). При этом на уровне тенденции снижалась скорость нарастания входящих и увеличивалась (p < 0,05) – скорость нарастания выходящих трансмембранных ионных токов (рис. 1, а, 3–4).
а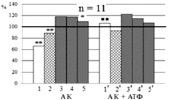 б
б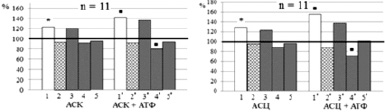 в
в
Рис. 1. Нейротропные эффекты индивидуальных и сочетанных с 5∙10–4 М аденозинтрифосфатом (АТФ) растворов аспирина, ацетилсалицилатов кобальта и цинка в концентрации 5∙10–4 М. Примечание: Аsp – аспирин, АСК – ацетилсалицилат кобальта, АСЦ – ацетилсалицилат цинка. Тестируемые растворы отмечены на диаграммах. Горизонтальной жирной линией обозначены значения фоновых показателей, принятые за 100 %; 1 – частота генерации импульсов, 2 – амплитуда потенциалов действия, 3 – скорость суммарных входящих ионных токов, 4 – скорость суммарных выходящих ионных токов, 5 – мембранный потенциал.1’ – 5’ – показатели электрической активности при сочетанной экспозиции салицилатов с АТФ. n – количество исследованных нейронов; * – p < 0,05, ** – p < 0,01 – достоверные изменения показателей контроля по сравнению с фоном; ■ – p < 0,05, ■■ – p < 0,01 достоверные изменения показателей эксперимента по сравнению с контролем
По сравнению с эффектами индивидуального раствора Аsp воздействие АК + АТФ (n = 11) увеличивало ЧГИ (p < 0,01) исследованных нейронов на 39,9 % (рис. 1, б, 1 и 1’). Таким образом, в присутствии АТФ угнетение ЧГИ, вызванное Аsp, нивелировалось. Это сопровождалось увеличением на уровне тенденции скорости нарастания суммарных входящих трансмембранных ионных токов и снижением – выходящих (рис. 1, а, 3–3’, 4–4’). Указанные изменения свидетельствуют о возрастании при действии АТФ и (или) продукта его распада – аденозина –проницаемости наружных мембран нейронов для Na+ и, возможно, Ca2+. Следует напомнить, что в плазматической мембране многих нейронов моллюсков Ca2+ -каналы отсутствуют, а добавление АТФ неспецифически нивелировало угнетающие эффекты Аsp у всех исследованных нейронов. Поэтому мы считаем, что повышение уровня внеклеточного АТФ приводило главным образом к активации Na+ -каналов. Раствор Аsp + АТФ на уровне тенденции также снижал и скорость нарастания суммарных выходящих ионных токов, что указывает на некоторое снижение проницаемости мембран для К+ (рис. 1, А, 4–4’). Это может быть связано с инактивацией АТФ-зависимого тока К+ [4].
Поскольку угнетающие нейротропные эффекты Аsp устранялись добавлением АТФ в окружающий нейроны раствор в количестве соответствующем его внутриклеточной физиологической концентрации, это даёт основание полагать, что механизм такого эффекта связан с нарушением синтеза АТФ на внутриклеточных мембранах нейронов и сокращением его выброса во внеклеточное пространство. Вызванный Аsp недостаток АТФ внутри и вне клеток может быть причиной снижения функциональной активности нейронов за счёт замедления скорости энергозависимых и опосредованных пуринэргической сигнализацией внутриклеточных процессов. Например, могла нарушаться электрогенная функция Na+–К+-насоса, активироваться АТФ-зависимый ток К+ [4].
Приложение растворов АСК и АСЦ достоверно повышало ЧГИ по сравнению с фоном, а добавление к этим агентам АТФ ещё больше увеличивало ЧГИ – на 19,2 и 26,8 % соответственно (p < 0,05; рис. 2, б и в, 1–1’). Растворы АСК + АТФ и АСЦ + АТФ достоверно (p < 0,01) уменьшали (рис. 1, б и в, 3’–4’) скорость нарастания суммарных выходящих ионных токов. Данные изменения свидетельствуют об ингибирующем действии АТФ на К+-каналы. Согласно данным [4], это может быть связано с инактивацией АТФ-зависимых К+-каналов, которые были обнаружены и в нейронах брюхоногих моллюсков. Кроме того, все протестированные соли в сочетании с АТФ на уровне тенденции увеличивали скорость нарастания суммарных входящих ионных токов (рис. 1, б-в, 3’), что согласно [6, 12] указывает на увеличение проницаемости натриевых и, возможно, кальциевых ионных каналов.
Не исключено, что усиление активирующих эффектов АСК и АСЦ при добавлении к ним АТФ может быть результатом и непосредственной активации тестируемыми солями синтеза АТФ на мембранах нейронов. В этом случае последовательность событий, происходящих в нейронах при воздействии растворов АСК + АТФ и АСЦ + АТФ, может быть следующей:
1. Под влиянием АСК, АСЦ происходит увеличение продукции АТФ на внутриклеточных мембранах и его выброса в наружную среду, а добавление АТФ во внеклеточную среду ещё больше увеличивает его содержание здесь.
2. Увеличение уровня АТФ выше физиологических концентраций может запускать последовательные реакции его дефосфорилирования экто-АТФазами и эктонуклеотидазами мембран [11]. Однако слишком большое количество АТФ, по-видимому, вызывает полное субстратное насыщение активных центров этих ферментов, разрушающих АТФ до аденозина.
3. Замедляется распад АТФ, вследствие чего он модулирует фукционирование ионных каналов, управляемых P2 рецепторами. Аденозин, образовавшийся в результате распада АТФ, может стимулировать процессы, опосредуемые P1 рецепторами.
Ранее нами было показано, что облегчающее и модулирующее влияние салицилатов на нейроны улитки опосредуется цАМФ [6], который является активатором/ингибитором различных подтипов P2 и P1 рецепторов [12]. В присутствии растворов АСК и АСЦ мы тоже наблюдали медленноволновые колебания МП, которые согласно [6] указывают на изменения концентрации цАМФ и цГМФ. Всё это свидетельствует в пользу предлагаемой нами выше схемы для объяснения эффектов сочетанного воздействия АТФ и солей Аsp, поскольку изменение концентрации цАМФ в нейронах может быть вызвано эффектами АТФ и аденозина [12], а в отношении самого Аsp известно, что он не только угнетает синтез АТФ, но и уменьшает содержание цАМФ [3]. Мы полагаем, что активирующие нейротропные эффекты АСК и АСЦ, в отличие от угнетающих Аsp, обусловлены увеличением синтеза АТФ и, следовательно, цАМФ. Если это так, то можно считать, что в механизме эффектов АСК и АСЦ значительную роль играют внеклеточный уровень АТФ и, по-видимому, его продукта – аденозина.
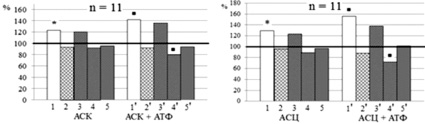
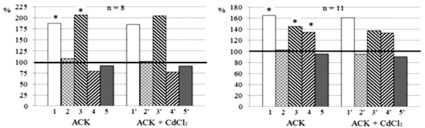
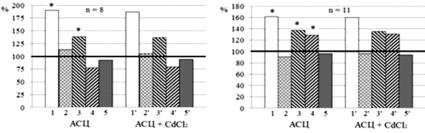
Нейротропные эффекты аспирина и его производных при блокаде входящего кальциевого тока хлоридом кадмия. Для выяснения роли входящего трансмембранного кальциевого тока в нейротропных эффектах Asp, АСК и АСЦ в серии экспериментов мы использовали его блокатор – CdCl2 [4, 5]. Как видно из рис. 2, эффекты приложения индивидуальных и сочетанных с CdCl2 растворов указанных веществ в концентрациях 5∙10–5 и 5∙10–4 М существенно не отличались.
 б
б
 г
г
 е
е
Рис. 2. Нейротропные эффекты приложения индивидуальных и сочетанных с CdCl2 растворов аспирина, ацетилсалицилатов кобальта и цинка. Примечание: концентрации веществ и CdCl2 в применяемых растворах 5∙10-5 (А, В, Д) и 5∙10-4 М (Б, Г, Е) Остальные обозначения те же, что и на рис. 1
Поскольку CdCl2 не изменял нейротропные эффекты тестируемых веществ, можно полагать, что они практически не связаны с входящим трансмембранным током Ca2+. Иными словами можно считать, что салицилаты не увеличивают проницаемость наружных мембран нейронов для Ca2+. Есть даже основания предполагать, что Аsp, АСК и АСЦ сами блокируют этот ионный ток.
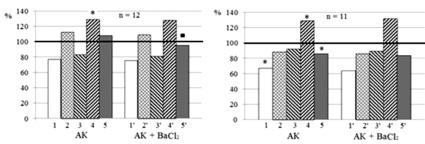
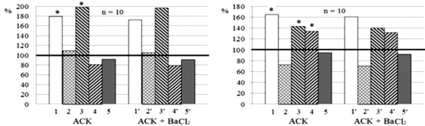
Однако отсутствие поступления Ca2+ из внеклеточной среды в нейроплазму могло компенсироваться за счет выделения Ca2+ из внутриклеточных депо [11] и благодаря ингибированию Ca2+-АТФ-азы плазматических мембран (PMCA), которая способствует выведению Са2+ из клетки против градиента его концентрации, ионами Сd2+ [8]. Для того, чтобы выяснить, так ли это, в следующей серии экспериментов вместо хлорида кадмия мы апплицировали на мембраны нейронов хлорид бария – блокатор выделения Са2+ из внутриклеточных депо, входящего тока Са2+ и выходящего Са2+ -зависимого калиевого тока [4, 9]. Следует напомнить, что ионы Ва2+ не влияют на работу PMCA [8].
 б
б
 г
г
 е
е
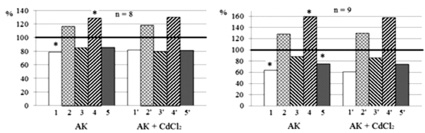
Рис. 3. Нейротропные эффекты приложения индивидуальных и сочетанных с BaCl2 растворов аспирина, ацетилсалицилатов кобальта и цинка. Примечание: концентрации тестируемых кислот и BaCl2 в используемых растворах 5∙10-5 (А, В, Д) и 5∙10-4 М (Б, Г, Е). Остальные обозначения те же, что и на рис. 1
Эффекты аспирина и его производных при блокаде хлоридом бария поступления ионов кальция в нейроплазму из наружной среды и внутриклеточных депо. Эффекты 5∙10–5 и 5∙10–4 М индивидуальных Аsp, АСК и АСЦ достоверно не отличались от их эффектов в сочетании с BaCl2 (рис. 3). Исключением было лишь снижение МП (p < 0,05) при действии 5∙10–5 М раствора Аsp + BaCl2 (рис. 3, а, 5–5’). Отмеченные изменения МП согласуются со сведениями литературы [4] о том, что BaCl2 может снижать МП. Полученные результаты свидетельствуют о том, что в механизмах нейротропного действия тестируемых салицилатов ионы Са2+ не участвуют.
Однако следует учесть, что вызванное блокаторами уменьшение поступления Са2+ в нейроплазму может компенсироваться за счёт других механизмов. Например, Сd2+ и Bа2+ эффективно блокируют потенциалзависимые L и N каналы входящего кальциевого тока и не оказывают существенного влияния на Т каналы [4], хотя они и встречаются редко в мембранах нейронов моллюсков [7]. Другой путь поступления Са2+ в нейроплазму при действии салицилатов и BaCl2 может обеспечиваться благодаря работе Na+–Са2+ -обменников, при этом направление переноса Са2+ через наружную мембрану зависит от концентрации Na+ по обе её стороны [11]. При поступлении Na+ внутрь клетки, Na+–Са2+ -обменники способствуют выводу Na+ из клетки и накоплению в нейроплазме Са2+ из внеклеточной среды и внутриклеточных депо [11]. Это могло происходить и в присутствии Ва2+, обладающих меньшим сродством к внеклеточным сайтам Na+–Са2+ -обменников, чем Са2+ [8].
Выводы
1. Нейротропные эффекты аспирина, ацетилсалицилатов кобальта и цинка существенно зависят от содержания во внеклеточной среде АТФ. Механизм угнетающего нейротропного действия аспирина в значительной степени связан со снижением концентрации АТФ во внеклеточной среде, а активирующие эффекты ацетилсалицилатов кобальта и цинка усиливаются в присутствии АТФ.
2. Блокирование входящего тока и выделения Са2+ из внутриклеточных депо с помощью CdCl2 и ВаCl2 показало, что эти ионы не участвуют в реализации нейротропного действия аспирина, ацетилсалицилатов кобальта и цинка. Однако существуют другие механизмы поступления Са2+ в нейроплазму, которые не подвержены действию использованных нами блокаторов (функционирование Т-каналов входящего кальциевого тока, работа Na+–Са2+-обменников). Участие этих механизмов в нейротропном действии салицилатов ещё предстоит выяснить.



