Функциональная реабилитация пострадавших с переломами берцовых костей остается актуальной проблемой травматологии, и одной из причин неудовлетворительных результатов лечения является нейропатия малоберцового нерва [3]. В настоящее время появляются исследования, доказывающие наличие нейрогенного контроля метаболизма костной ткани, что указывает на участие периферической нервной системы посредством нейромедиаторов в регенерации и ремоделировании скелетной ткани, в том числе и при переломах [8]. Имеются экспериментальные данные о неоднозначном характере влияния денервации на заживление переломов: объём периостальной костной мозоли в зоне перелома большеберцовой кости крыс в опытах с перерезкой седалищного нерва повышается, но её плотность и прочность сращения оказываются ниже контроля [6]. Дальнейшие исследования в этой области являются перспективными, так как позволят изучить механизмы нейрогенного контроля скелетных тканей и открыть новые направления в лечении остеопороза, артропатии и заживлении переломов [7].
При моделировании оскольчатых переломов костей голени у собак признаки повреждения малоберцового нерва наблюдались в 11,1 % случаев, но даже в опытах с отсутствием признаков механического повреждения нерва выявлены изменения эпиневрия и периневрия, свидетельствующие об усилении структурно-функциональных характеристик периневрального барьера и гистогенезе структур, обеспечивающих механическую прочность нерва и поддержание гомеостаза среды микроокружения нервных волокон [4]. Состояние безмиелиновых и миелинизированных волокон в этих условиях нельзя считать детально изученным.
Цель исследования – проанализировать изменения численных и размерных характеристик нервных волокон поверхностного малоберцового нерва (МН) в динамике заживления переломов костей голени.
Материалы и методы исследования
Эксперимент проведен на 21 беспородной собаке с массой тела 11–20 кг, в возрасте 3–5 лет, которым в условиях операционной под внутривенным комбинированным наркозом моделировали оскольчатый перелом в средней трети правой голени ударом груза массой 5 кг в свободном падении с высоты 1,5 м. В течение суток осуществляли иммобилизацию голени шиной, затем выполняли закрытый чрескостный остеосинтез аппаратом Илизарова. Животные выводились из эксперимента передозировкой барбитуратов в разные сроки фиксации голени в аппарате – 7 (Ф7, n = 3), 14 (Ф14, n = 3), 21 (Ф21, n = 3), 35–37 (Ф35–37, n = 4) и 49–50 (Ф49–50, n = 3) суток, через 90 (Ф49–50БА90, n = 3) и 120 (Ф49–50БА120, n = 2) суток после снятия аппарата. Срок окончания периода фиксации и снятия аппарата определяли по рентгенологическим признакам формирования костной мозоли и после проведения клинической пробы, позволяющей констатировать отсутствие микроподвижности в зоне интереса после приложения к ней разнонаправленных усилий. Содержание, питание, уход, оперативные вмешательства и эвтаназию осуществляли в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (приложение к приказу МЗ СССР от 12.08.1977 № 755). Все манипуляции, проводимые на животных, были рассмотрены и одобрены этическим комитетом.
Участки МН оперированной и контралатеральной конечностей (уровень средней трети голени) фиксировали в смеси 2 % растворов глутарового и параформальдегидов на фосфатном буфере (рН 7,4) с добавлением 0,1 % пикриновой кислоты, постфиксировали в 1 % растворе тетраоксида осмия с 1,5 % красной кровяной солью и заливали в аралдит. В оцифрованных на аппаратно-программном комплексе «DiaMorph» (Москва) изображениях тотальных поперечных полутонких срезов нервов, окрашенных метиленовым синим и основным фуксином, определяли общую площадь поперечного сечения нерва (An), суммарную площадь пучков нервных волокон с периневрием (Af-pn), численные плотности эндоневральных микрососудов (NAms), миелиновых (МВ) и безмиелиновых волокон (NAmf и NAаmf) в 1 мм2, коэффициент NAamf/NAmf, долю деструктивно измененных МВ (Deg %), средние диаметры МВ (Dmf), их аксонов (Dax), коэффициент G (Dax/Dmf), толщину миелиновой оболочки (Lm). Строили гистограммы распределения МВ по диаметрам с шагом 1 мкм. Производили учёт ядросодержащих профилей МВ крупного калибра (более 7 мкм диаметром) и рассчитывали ядерный индекс (Jnuc), как процентную долю ядросодержащих профилей МВ в выборке из 200 и более проводников. Контроль – МН 5 интактных собак. Статобработку проводили по парному двухвыборочному t-тесту и критерию Вилкоксона для независимых выборок (тесты запрограммированы И.П. Гайдышевым [1] и помещены в динамически подключаемую библиотеку программы Microsoft Exel 97).
Результаты исследования и их обсуждение
Консолидация перелома голени наступает в сроки от 42,0 до 50,0 суток эксперимента (46,3 ± 1,5 суток).
Все оболочки МН у большинства животных сохраняют целостность. При планиметрическом исследовании тотальных поперечных срезов МН у двух собак через 14–21 сутки опыта регистрируется повышение (р < 0,05) An оперированной конечности на 12–13 % и Af-pn на 5–16 % (р < 0,05) относительно аналогичных параметров контралатерального МН. Через 35–37 суток фиксации достоверные различия по параметру An отсутствуют, и только у одной собаки обнаруживается повышение на 5 % (р < 0,05) Af-pn оперированной конечности. Через 50 суток фиксации и в остальные сроки эксперимента достоверные различия по параметрам An и Af-pn отсутствуют.
Через 7, 14 и 21 сутки фиксации голени в аппарате в МН наблюдаются аналогичные морфологические изменения. Эпиневрий отечный, обнаруживаются признаки реактивного воспаления. Стенки большинства эпиневральных кровеносных сосудов утолщены, просветы расширены, нередко состояние эритроцитарного стаза. Часть микрососудов имеют облитерированные просветы и признаки дистрофических и деструктивных изменений.
Периневрий сохраняет тонколамеллярное строение, но возрастает количество ядер периневральных клеток (ПК) и увеличиваются объемы волокнистых прослоек. Между слоями ПК формируются многочисленные мостики, представленные цитоплазматическими клеточными выростами. В отдельных пучках наблюдаются незначительные субпериневральные отеки. Эндоневральные кровеносные сосуды в отличие от интактного МН имеют преимущественно расширенные просветы, часть – признаки деструктивных изменений клеточных элементов стенки. Обнаруживаются МВ с признаками демиелинизации, аксональной и валлеровской дегенерации (рис. 1).
Через 7 суток Deg % (12,51 ± 3,62 %) превышает значения интактного МН (1,85 ± 0,60 %) в 6,2 раза, что сопровождается снижением (рис. 1) у большинства животных NAmf (19595 ± 3702), NAаmf (11316 ± 2306) и коэффициента NAamf/NAmf до 0,604 ± 0,214, что на 22 % ниже нормы (0,776 ± 0,121). В интактных МН показатели NAmf и NAamf составляют в среднем 21335 ± 1130 и 16479 ± 1944 в 1 мм2 соответственно. Jnuc приближен к значениям интактного МН. Lm не изменяется, а уменьшение (p < 0,01) Dax, свидетельствующее о нарушении аксоплазматического тока и приводит к снижению (p < 0,01) Dmf и коэффициента G ( таблица).
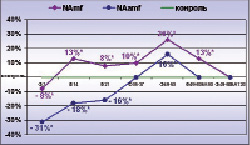
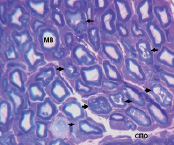
Рис. 1. Слева: график динамики NAmf и NAamf на этапах эксперимента, отражающий разницу в процентах между NAmf и NAamf опытного и интактного нервов. * – различия между NAmf и NAamf опытного и интактного нервов достоверны по критерию Вилкоксона для независимых выборок при p < 0,01. Справа: нервные волокна МН через 20 суток фиксации голени в аппарате. МВ – миелиновые волокна, стрелки – деструктивно измененные МВ, СПО – субпериневральный отек. Поперечный полутонкий срез, окраска метиленовым синим и основным фуксином. Об. 40, ок. 12,5х
Размерные характеристики МВ опытного и интактного МН нервов (м ± σ)
|
Срок экспер. |
Dmf (мкм) |
Dax (мкм) |
G (Dax/Dmf) |
Lm (мкм) |
Jnuc (%) |
|
Ф 7 |
6,29 ± 0,70* |
4,18 ± 0,53* |
0,670 ± 0,016 |
1,06 ± 0,11 |
2,77 ± 0,43 |
|
Ф 14 |
6,08 ± 0,08* |
4,17 ± 0,01* |
0,686 ± 0,008 |
0,95 ± 0,04* |
5,13 ± 1,06 |
|
Ф 20 |
5,98 ± 0,32* |
4,04 ± 0,35* |
0,697 ± 0,018 |
0,97 ± 0,01* |
5,06 ± 2,29 |
|
Ф 37-39 |
5,78 ± 0,15* |
3,73 ± 0,19* |
0,650 ± 0,011 |
0,67 ± 0,48* |
3,80 ± 0,25 |
|
Ф 50 |
5,03 ± 0,56* |
3,40 ± 0,20* |
0,676 ± 0,066 |
0,82 ± 0,13* |
3,89 ± 0,45 |
|
Ф50БА90 |
5,89 ± 0,07* |
3,98 ± 0,14* |
0,676 ± 0,012 |
0,96 ± 0,05* |
4,03 ± 0,44 |
|
Ф50БА120 |
6,21 ± 0,39* |
4,15 ± 0,24* |
0,671 ± 0,004 |
1,07 ± 0,09 |
2,90 ± 0,49 |
|
Инт. МН |
6,46 ± 0,07 |
4,39 ± 0,08 |
0,679 ± 0,010 |
1,04 ± 0,04 |
2,63 ± 0,00 |
Примечание. * – различия между значениями размерных характеристик опытного и интактного МН достоверны по критерию Вилкоксона для независимых выборок при p < 0,01.
Исследование эндоневральной васкуляризации показало, что через 7 и 14 суток опыта у всех животных регистрируется снижение NAms (188 ± 30 и 172 ± 25 соответственно) относительно контроля (в интактном МН – 220 ± 39), но только у 2-х собак снижение NAms на 29–30 % является статистически достоверным (p < 0,01).
Deg % через 14 суток остается высокой – 11,79 ± 0,30 %. В результате регенераторных процессов NAmf возрастает до 24462 ± 2883 и превышает контроль (рис. 1). NAаmf возрастает до 13394 ± 992, но остается сниженной относительно контроля (рис. 1), коэффициент NAamf/NAmf (0,549 ± 0,024) – на 29 %. Все размерные характеристики МВ оказываются ниже нормы ( таблица). Снижение Dmf происходит за счет снижения Lm, что сопровождается ростом G ( таблица) и Jnuc. Изменение показателя Jnuc дает возможность косвенно оценить динамику изменения длины интернодальных сегментов на этапах эксперимента, и повышение данного показателя свидетельствует об увеличении числа коротких «вставочных» интернодальных сегментов вследствие происходящих в нерве процессов демиелинизации и последующей ремиелинизации.
Через 7 и 14 суток распределение МВ по диаметрам, как и в контроле, имеет бимодальный характер (рис. 2). Основание гистограммы увеличивается с правой стороны на 1 разряд: появляются МВ диаметром 13,1–14,0 мкм. Доля МВ малого калибра (2,1–4,0 мкм) возрастает на 7–10 %, крупных (Dmnf > 7,1 мкм) – снижается на 3 %, что приводит к сглаживанию правого пика гистограммы и повышению левого.
Через 20 суток Deg % немного снижается (8,85 ± 4,77 %), но превышает норму в 4 раза. NAms повышается до 281 ± 32 и превышает контроль на 28 % (p < 0,01). NAmf (23123 ± 4307) остается выше нормы, а NAаmf возрастает до 13832 ± 2795, но не достигает контроль (pис. 1), а NAamf/NAmf (0,592 ± 0,017) остается сниженным – на 24 %. Такое изменение численных плотностей микрососудов и волокон при неизменной Af-pn, либо ее повышении у отдельных животных, свидетельствует о гиперваскуляризации эндоневрия и отражает реальный рост численности популяции МВ при одновременном снижении численности, либо топографическом перераспределении безмякотных проводников. Dmf, Dax и Lm продолжают снижаться, а G – расти, Jnuc в 1,9 раза превышает контроль ( таблица). Бимодальность распределения МВ сохраняется, основание гистограммы смещается влево: появляются новообразованные МВ диаметром 1,0–2,0 мкм, и исчезают крупные диаметром 13,1–14,0 мкм.
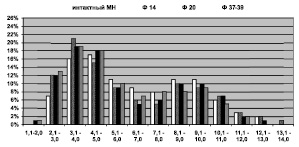
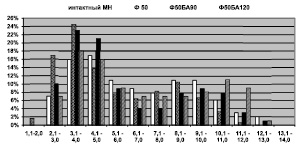
Рис. 2. Гистограммы распределения МВ по диаметрам в интактном МН и опытном на этапах эксперимента. Ось абсцисс – размерные классы, ось ординат – доли МВ каждого класса в %
Через 35–37 суток фиксации в эпиневрии МН обнаруживаются коллагеновые депозиты, наблюдается его гиперваскуляризация. Артериолы и венулы гипертрофированы. Часть сосудов имеет признаки деструктивных изменений клеточных элементов стенок. Периневрий сохраняет тонколамеллярное строение, волокнистые прослойки между слоями периневральных клеток остаются утолщенными. NAms превышает норму на 30 % (287 ± 93). Deg % снижается до 4,64 ± 0,85 %, что в 2,4 раза выше контроля. Обнаруживаются единичные мелкие новообразованные волокна с тонкой миелиновой оболочкой и регенерационные кластеры. NAmf (23742 ± 2057) остается повышенной (рис. 1). NAаmf (16429 ± 1116) приближается к норме (рис. 1). NAamf/NAmf (0,693 ± 0,017) остается пониженным на 11 %. Dmf, Dax, Lm продолжают снижаться, а Jnuc превышает контроль в 1,4 раза ( таблица). Гистограмма уменьшается справа на 1 разряд: не обнаруживаются МВ диаметром 12,1–13,0 мкм, имеющиеся в интактном МН.
Через 48–50 суток в МН сохраняется эпиневральная и эндоневральная гиперваскуляризация, NAms на 40 % превышает контроль(p < 0,01). NAmf и NAаmf продолжают расти (рис. 1). Deg % в 3 раза превышает норму, Dmf, Dax, Lm продолжают снижаться, G приближается к норме, Jnuc в 1,5 раза превышает контроль ( таблица). Гистограмма распределения МВ по диаметрам, как и на предыдущем сроке, состоит из 11 разрядов: волокна имеют диаметры от 1,0 до 12,0 мкм. Доля МВ диаметром менее 2,1 мкм возрастает до 2 %, что свидетельствует о происходящих в нерве регенераторных процессах. Доля мелких МВ (1,0–4,0 мкм) в среднем на 20 % превышает норму, доля крупных МВ (> 7,1 мкм) снижается на 3 % и остается ниже нормы в среднем на 11 %.
Через 140–170 суток эксперимента в МН сохраняется эпиневральная и эндоневральная гиперваскуляризация. NAms составляет 281 ± 96 и 394 ± 86 в 1 мм2 соответственно, что на 22 и 79 % выше контрольных значений. Количество МВ с признаками деструктивных изменений остается повышенным: Deg % через 140 и 170 суток составляет 4,74 ± 0,43 % и 4,16 ± 0,71 %, что в 2,2–2,5 раза выше нормы. NAmf и NAаmf через 140 суток снижаются относительно предыдущего срока (рис. 1). NAamf/NAmf остается пониженным. Через 170 суток только у одной собаки NAmf остается повышенной на 16 % (p < 0,01), значение коэффициента NAamf/NAmf нормализуется. Размерные характеристики МВ начинают расти, но не достигают значений интактного МН ( таблица). Jnuc через 140 суток превышает контроль в 1,5 раза и нормализуется к концу опыта. Гистограммы распределения МВ по спектру калибров через 140–170 суток эксперимента практически идентичны. Бимодальность распределения сохраняется, первая мода сохраняет высокие значения (23 % и 18 %) и смещена относительно нормы в область более мелких проводников – 3,1–4,0 мкм. Основание гистограммы смещается на 1 разряд вправо и совпадает с основанием гистограммы интактного МН.
Таким образом, при экспериментальном моделировании и лечении высокоэнергетических оскольчатых переломов костей голени методом чрескостного остеосинтеза в МН обнаруживаются реактивно-деструктивные, компенсаторно-приспособительные и регенераторные реакции, направленные на поддержание гомеостаза. Наблюдаемые изменения клеточных и волокнистых компонентов периневрия аналогичны изменениям, описанным при дистракционном остеосинтезе у собак [5], но менее выражены, чем при «больших» удлинениях голени [2].
Динамика колебания численных плотностей нервных проводников свидетельствует о большей травматизации безмякотных волокон, численность которых в течение первых трех недель эксперимента снижается на 16–31 %, что при незначительном (на 5–16 %) возрастании суммарной площади пучков может быть связано не только с их топографическим перераспределением, но и с их реальной потерей. Численная плотность миелиновых проводников снижается только через неделю фиксации голени. В последующие сроки в МН обнаруживаются мелкие новообразованные волокна с тонкой миелиновой оболочкой и регенерационные кластеры. NAmf и NAamf и G начинают расти и достигают максимальных значений к 50-м суткам лечения, а затем снижаются и приближаются к контролю. Аналогичную динамику количества нервных проводников Suzuki A., Uemura T., Nakamura H. (2010) наблюдали в новообразованной кости при заживлении переломов – нервные волокна быстро восстанавливаются и увеличивают свою численность, а в последующий период реабилитации их численность постепенно нормализуется. G. Castaneda-Corral. et al. (2011) установили, что иннервирующие кость сенсорные нервные волокна постоянно выделяют нейротрофический фактор GAP43, участвующий в росте аксонов и регенерации нервов, что связывают с постоянной физиологической реконструкцией кости в течение жизни и необходимости обеспечения иннервации новообразованной кости, а при переломах выработка GAP43 существенно возрастает. Следует отметить, что в нашем исследовании максимальный рост численности нервных проводников по времени совпадает со сроком консолидации перелома – от 42,0 до 50,0 суток эксперимента. Полученные результаты дают основание предположить, что периферические нервы могут играть важнейшую роль в процессах заживления перелома кости посредством арборизации нервных проводников и вырабатываемых ими нейромедиаторов.
Заключение
Полученные экспериментальные данные послужат теоретической основой поиска рациональных способов нейрометаболической фармакотерапии для оптимизации консолидации переломов и разработки эффективных методов реабилитации с целью предотвращения развития возможных осложнений неврологического характера и улучшения функции конечности.



