Одним из основных, широко применяющихся методов изучения в патофизиологии является метод моделирования болезней, болезненных состояний, патологических процессов, а также организма в целом [1]. Причем его воспроизведение на реальных биологических объектах имеет преимущество в сравнении с формализованными моделями, поскольку позволяет в большей степени приблизить совокупность факторов сопровождающих и воздействующих на патологический процесс к реальным условиям возникновения и протекания заболевания.
Важность изучения формирования атрофических рубцов и последующего использования их моделей в изучении методов их коррекции обусловлена, с одной стороны, широкой распространенностью данного вида рубцевания, например, после угревой болезни, ветряной оспы, травм кожи [3] и существенным влиянием на социальную дизадаптацию подобных пациентов [4], с другой – малой эффективностью существующих методов лечения [5, 6].
Целью исследования было создание и изучение морфологических характеристик ткани полученного атрофического рубца кожи.
В ходе работы по созданию модели атрофического рубца кожи у лабораторных животных, мы провели ревизию известных и используемых методов, в результате чего обнаружилось, что большая их часть подразумевает механическую, операционную травматизацию кожного покрова, сопровождаемую в ряде случаев механическими же способами формирования минус-ткани [2].
В предложенном нами методе используется свойство протеолитического фермента вызывать локальный лизис белкового компонента соединительной ткани. Атрофический рубец в этом случае получается путем интрадермального введения в кожу крысы протеолитического фермента, что достигается инъекцией туннельноретроградным способом, параллельно поверхности кожи раствора коллагеназы с содержанием не менее 100КЕ в средние слои дермы предварительно депилированного в рабочей области лабораторного животного.
Наша методика апробирована на 15 крысах. В качестве рабочего раствора использован препарат «Коллализин», в разведении 500 КЕ в 1 мл. В ходе процедуры параллельно поверхности кожи, вдоль позвоночника лабораторного животного, на расстоянии 2 см от него, в толщу сетчатого слоя дермы вводят на всю длину иглу инсулинового шприца (16×0,4). Для соблюдения условия введения иглы на требуемую глубину производился визуальный контроль – игла должна четко контурироваться при её поднятии, но поверхность иглы (её цвет) не должна быть видна. Затем, туннельно-ретроградным способом, при плавном вытягивании иглы и равномерном давлении на поршень шприца, вводили 0,2 мл раствора коллагеназы с содержанием не менее 100KE.
В результате применения данного метода, в области проекции на поверхность кожи введенного интрадермально объема раствора коллагеназы, в течение 7–10 дней, формируется выраженный линейный атрофический рубцовый дефект.
Морфологические характеристики рубцовой ткани оценивали после трепанационной биопсии рубцового дефекта дна атрофического рубца. Биопсию проводили оригинальным трубчатым ножом с получением цилиндрического образца ткани диаметром 2 мм, включающего все слои кожи. Окраску биоптатов проводили гематоксилин-эозином и по Ван-Гизону. Оценивались толщина кожи в области дна образованного рубца и контрольного биоптата (эпидермиса и дермы), вид коллагеновых волокон, плотность заполнения среза коллагеновыми волокнами.
В результате после инъекции протеолитического фермента, через 7 минут мы получили появление в месте инъекции выраженного отека, усиливающегося к 30-й минуте и геморрагического окрашивания кожи в проекции на нее инъецированного пула препарата, усиливающегося также к 30-й минуте и тогда же заканчивающееся излиянием крови на поверхность кожи, с последующим образованием геморрагической корки на 55 минуте (таблица).
Динамика макроскопических визуализируемых изменений после инъекции 0,2 мл раствора коллагеназы, содержащего 100 КЕ в толщу дермы крыс
|
№ п/п |
Наблюдаемые признаки развития лизиса тканей кожи |
|||
|
Отек |
Внутрикожная геморрагия |
Излияние крови на поверхность |
Образование геморрагической корки |
|
|
Появление/максимальное проявление признаков с момента инъекции, через время, мин |
||||
|
1. |
4/32 |
10/32 |
34 |
50 |
|
2. |
5/30 |
11/31 |
29 |
54 |
|
3. |
5/26 |
10/34 |
28 |
46 |
|
4. |
10/30 |
12/30 |
31 |
55 |
|
5. |
9/30 |
10/30 |
31 |
55 |
|
6. |
5/30 |
9/25 |
23 |
54 |
|
7. |
5/18 |
9/24 |
24 |
57 |
|
8. |
6/25 |
11/32 |
27 |
58 |
|
9. |
4/23 |
9/25 |
28 |
47 |
|
10. |
5/25 |
10/26 |
26 |
47 |
|
11. |
7/24 |
11/33 |
29 |
60 |
|
12. |
6/31 |
10/31 |
27 |
48 |
|
13. |
5/29 |
11/31 |
31 |
63 |
|
14. |
5/29 |
11/34 |
30 |
61 |
|
15. |
5/31 |
11/35 |
32 |
59 |
|
Среднее время |
5,7/27,5 |
10,3/30,2 |
28,7 |
54,3 |
Минус-ткань линейной формы образовывалась во всех случаях инъецирования коллагеназы в кожу крысы вышеуказанным способом. Ширина и глубина рубцового дефекта варьировала, вероятно, по причине неравномерного поступления препарата в толщу дермы при мануальном давлении на поршень шприца.
По данным [7], гистологически ткань рубца атрофического выглядит как ткань рубца нормотрофического и за исключением меньшей васкуляризации отличия представлены лишь макроскопически, а именно: в западении поверхности рубцового дефекта относительно уровня поверхности окружающей кожи. Таким образом можно утверждать, что полученные из образованного описанным способом рубца биоптаты дали гистологическую картину атрофического рубца кожи (рисунок).
Мы считаем, что данный метод формирования атрофического рубца кожи более приближен к механизму образования последнего во время заболеваний, частым последствием и осложнением которых этот вид рубцов является, например, угревой болезни. И в нашей модели и во время болезни, рубец образуется при разрушении соединительнотканной основы кожи из очага, находящегося в её толще. В первом случае мы этот очаг искусственно создаем путем инъецирования коллагеназы, фермента, лизирующего коллагеновую строму кожи вокруг депо препарата, во втором – центр воспаления с энзимным расплавлением дермы, являющимся следствием воздействия на соединительную ткань ферментов, высвобождающихся при разрушении и воздействии фагоцитарного компонента иммунной реакции в этом очаге, например, нейтрофилов.
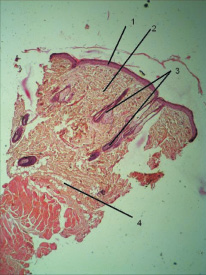
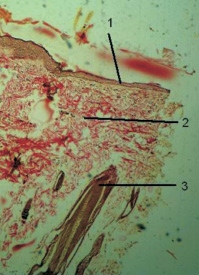
Атрофический рубец кожи крысы. Окраска по Ван-Гизону. Ув. 400:1 – эпителий; 2 – дерма (коллагеновые волокна соединительной ткани дермы); 3 – придатки кожи, волосы и сальные железы; 4 – подкожножировая клетчатка. На рисунке видно истончение эпителия над рубцовой тканью, меньшая толщина коллагеновых волокон
Таким образом, путем однократного введения 0,2 мл раствора коллагеназы с содержанием не менее 100KE в толщу сетчатого слоя дермы параллельно поверхности кожи туннельно-ретроградным способом, мы получили модель, пригодную для исследований как образования, так и коррекции атрофического рубца кожи на разных этапах его формирования.



