Патогенные микроорганизмы, способные обитать в объектах окружающей среды, относятся к возбудителям сапрозоонозов или факультативным паразитам. К настоящему времени число микроорганизмов, характерной особенностью которых является способность вести как сапрофитный, так и паразитический образ жизни, неуклонно растет. Известно, что изменение природных абиотических факторов среды (температура, солёность, рН, влажность, кислородный режим, питательный субстрат) приводит к изменению биологических свойств патогенных бактерий, включая вирулентность [6]. Современная окружающая среда испытывает мощное влияние факторов антропогенного характера, к числу которых можно отнести тяжелые металлы, определенным образом воздействующие и на микроорганизмы.
Тяжёлые металлы играют двойственную роль в процессах жизнедеятельности микроорганизмов. Некоторые из них – Mo, Cu, Mn, Zn, Ni являются жизненно необходимыми в небольших количествах. Так, общеизвестно, что ионы металлов входят в состав многих биологически важных макромолекул (ферментов, гормонов, витаминов, дыхательных пигментов, липидов и т.д.) и являются их необходимой частью, без которой не реализуется их физиологическая функция. Другие – Cd, Pb, Sn, Hg, Ag, Co – не выполняют биологических функций, однако, при высоких концентрациях все эти элементы, за счёт хорошей способности к комплексообразованию, являются чрезвычайно токсичными для микробов. Они могут взаимодействовать с гидроксильными, карбоксильными, фосфатными, сульфгидрильными и аминогруппами, вызывая изменения свойств белков, нуклеотидов, коферментов, фосфолипидов, в состав которых входят перечисленные группировки, а также токсичность проявляется в нарушении процессов окислительного фосфорилирования и поддержания осмотического баланса клеток. Металлы могут влиять на процессы, протекающие в клетке, только проникая внутрь её и фиксируясь на субклеточных мембранах [8].
К настоящему времени установлено, что клетки разных микроорганизмов способны аккумулировать тяжёлые металлы в количествах, намного превышающих потребность в них как в компонентах питания. Накопление металла приводит к его значительному концентрированию в клетках по отношению к среде. Из литературных данных известно, что микроорганизмы проявляют устойчивость фактически ко всем тяжёлым металлам [10].
Общим механизмом действия разных тяжёлых металлов является ингибирование ими дыхания у микроорганизмов. Этот эффект в ряде случаев, но не во всех, наблюдается при сравнительно более высоких концентрациях металлов, чем те, которые ингибируют рост [4]. Известно, что при действии тяжёлых металлов в клетках микроорганизмов происходит целый ряд деградативных изменений, которые могут вести к ингибированию их размножения. Так, под действием тяжёлых металлов наблюдаются изменения в содержании и синтезе основных полимеров в клетках. Тяжёлые металлы могут оказывать мутагенное действие на микроорганизмы, вызывая увеличение частоты мутаций, хромосомные аберрации или другие разрушения ДНК [3].
Цель исследования. Приведенные данные получены при изучении сапрофитных микроорганизмов, в отношении патогенных бактерий, способных существовать в объектах окружающей среды, такие исследования не проводились. Поэтому целью настоящей работы было определение минимальной ингибирующей концентрации катионов тяжёлых металлов, оказывающей влияние на размножение патогенных бактерий.
Материал и методы исследования
Объектами исследования были: Listeria monocytogenes (1/2а и 1/2b) – из коллекции НИИЭМ им. Н.Ф. Гамалея; 4b – из коллекции ВГНКИ ветеринарных препаратов; Yersinia pseudotuberculosis (2781, 3515, 907), Esherihia coli (1147) – коллекция НИИЭМ, Владивосток; Staphylococcus aureus (6538р/206р) – ФТУЗ Хабаровская противочумная станция. Для приготовления жидких сред использовали основы следующего состава: для культивирования L. monocytogenes – бульон для листерий (рыбный бульон с аминным азотом 110 мг %, дрожжевой экстракт сухой 1 %, глюкоза 0,2 %, рН 7,3); для Y. pseudotuberculosis и E. coli – бульон Хоттингера (рН 8); для S. aureus (6538р/206р) – сахарный бульон (бульон Хоттингера с 1 % глюкозы). Подбирали минимальную ингибирующую концентрацию солей тяжёлых металлов.
Для изучения динамики роста исследуемых бактерий в средах, содержащих соли тяжёлых металлов, использовали одни и те же концентрации солей для Y. pseudotuber-culosis, L. monocytogenes, E. coli и S. аureus. Предварительно штаммы подращивали в течение одних суток на плотных питательных средах, содержащих те же концентрации тяжёлых металлов, что и в жидкой среде. Динамику роста патогенных бактерий наблюдали в течение 7 дней при температуре 20–22 °С. В качестве контрольных – использовали те же среды для культивирования бактерий, но без катионов металлов. Патогенные бактерии добавляли в питательные среды с солями тяжелых металлов в дозе – 103 КОЕ/мл. Численность бактерий определяли спектрофотометрически по оптической плотности (ОП) культуральной среды при λ 600 нм на спектрофотометре Т70 UV/VIS Spectrometer PG Instruments Ltd (Англия).
Ингибирующее действие катионов тяжёлых металлов на размножение патогенных бактерий определяли по изменению концентрации микроорганизмов в точке их максимального роста по отношению к контролю, выраженному в процентах: ОПО600/ОПК600∙100–100 % (100 % – контроль) [1] (рисунок).
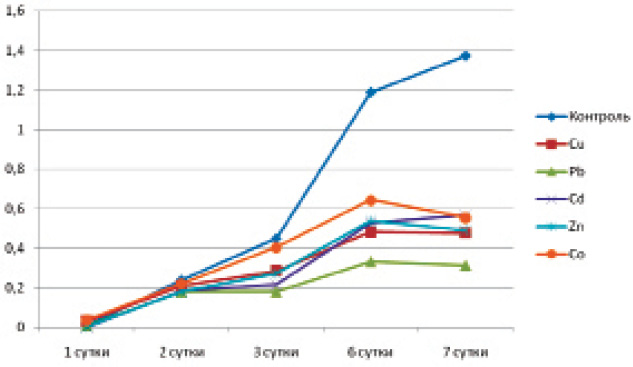
Динамика роста Y. pseudotuberculosis (шт. 3515) в питательном бульоне с солями тяжёлых металлов при температуре 20 °С (6 сутки – точка сравнения результатов)
Результаты исследования и их обсуждение
Данные, полученные в результате исследования, представлены в таблице, из которой видно, что листерии, по сравнению с другими тест-микроорганизмами, быстро откликаются на воздействие тяжелых металлов. Так, свинец, кобальт, цинк , медь и кадмий ингибировали рост L. monocytogenes уже на 2–3 сутки.
Минимальные ингибирующие концентрации (МИК) солей тяжелых металлов, определенные для патогенных бактерий (мг/л)
|
Штамм |
Cu2+ |
Pb2+ |
Cd2+ |
Zn2+ |
Co2+ |
|
Y.pseudotuberculosis (шт. 3515) |
6 ± 0,4 (5) |
98,2 ± 1,7(3) |
0,8 ± 0,1 (3) |
5,36 ± 1,1(5) |
2 ± 0,1 (6) |
|
Y.pseudotuberculosis (шт. 2781) |
12 ± 0,2 (7) |
98,2 ± 0,9 (7) |
0,8 ± 0,1(7) |
5,36 ± 1,3 (6) |
2 ± 0,1 (7) |
|
Y.pseudotuberculosis (шт. 907) |
12 ± 0,2 (7) |
98,2 ± 0,8 (7) |
0,8 ± 0,15(6) |
5,36 ± 1,1 (7) |
2 ± 0,2(6) |
|
L. monocytogenes (шт. 1/2b) |
6 ± 0,4 (2) |
98,2 ± 1,5(3) |
0,8 ± 0,2(3) |
5,36 ± 1,0(3) |
2 ± 0,0 (3) |
|
L. monocytogenes (шт. 1/2a) |
12 ± 0,2 (2) |
1960 ± 45(3) |
0,8 ± 0,3 (3) |
8,06 ± 1,0(3) |
2 ± 0,1 (2) |
|
L. monocytogenes (шт. 4b) |
12 ± 0,1(2) |
1960 ± 36(3) |
1,6 ± 0,4(3) |
8,06 ± 1,2 (3) |
3 ± 0,4(3) |
|
E. coli (1147) |
12 ± 0,4 (7) |
98,2 ± 1,5(7) |
1,6 ± 0,3(7) |
8,06 ± 1,1 (7) |
3 ± 0,1 (6) |
|
S. aureus (6538р/206р) |
6 ± 0,3(7) |
98,2 ± 1,8(3) |
1,6 ± 0,2(7) |
8,06 ± 1,0(7) |
2 ± 0,2 (3) |
Примечание. В скобках () указаны сутки, в течение которых произошло ингибирование.
Аналогичные результаты были получены и в отношении S. аureus при воздействии свинца и кобальта. Очевидно, что кобальт и свинец, поступающие в среду в результате техногенного загрязнения, оказывают быстрое угнетающее воздействие на процессы роста в большей степени грамположительных бактерий, по сравнению с грамотрицательными, что может быть связано с особенностью строения клеточной стенки. Так, у некоторых штаммов S. аureus тяжелые металлы вызывают конформационные изменения в клеточной мембране, обусловленными экспрессией плазмидных генов [7].
В условиях повышенных концентраций тяжёлых металлов в среде у микроорганизмов могут происходить изменения в клеточной стенке, оболочке, цитоплазматической мембране. Эти процессы не всегда являются результатом токсического действия металлов. Они могут быть проявлением индуцируемых защитных механизмов, обеспечивающих ограничение поступления токсичных ионов в цитоплазму клетки и воздействия на жизненно важные клеточные компоненты [2].
В нашем эксперименте дольше всех реакция на воздействие тяжелых металлов наблюдалась у E. coli (6 и 7 сутки). Известно, что эти микроорганизмы относят к санитарно-показательным, хотя в последнее время отмечают их высокую устойчивость к факторам внешней среды [5]. В отношении E. coli. известно, что поступление избыточных концентраций тяжелых металлов в клетку происходит за счёт индуцированного нарушения синтеза белка порина, участвующего в формировании транспортных каналов [9].
Если сравнивать полученные данные на уровне штаммов, то у иерсиний наблюдали стабильные результаты для всех штаммов в отношении взятых в эксперимент тяжелых металлов. Исключение составил штамм 3515, на который свинец и кадмий воздействовали быстрее, по сравнению с другими штаммами. У листерий особенно следует выделить шт. 1/2а и 4b L. monocytogenes, которые накапливали в больших количествах свинец (на два порядка выше по сравнению с остальными штаммами) прежде, чем он оказывал ингибирующее действие на рост бактерий. Тем не менее, у штамма 1/2b L. monocytogenes МИК свинца совпадали с таковыми для других штаммов, следовательно, металлы по-разному влияют на патогенные бактерии, даже на уровне штаммов, что возможно связано с их биологическими особенностями (выделены из разных мест обитания).
Действие МИК солей тяжёлых металлов на размножение патогенных бактерий по мере их возрастания можно расположить в следующий ряд: Pb2+ > Cu2+ > Zn2+ > Co2+ > Cd2+. Так, в большей степени токсичны Cd2+ и Co2+, т.к. уже небольшие концентрации этих металлов угнетают размножение исследуемых бактерий. В отношении тяжёлых металлов можно отметить, что МИК свинца, по сравнению с другими элементами, наиболее высок для всех штаммов, взятых в эксперимент. Следовательно, свинец в меньшей степени, по сравнению с другими тяжелыми металлами, тормозит рост патогенных бактерий.
Заключение
Таким образом, патогенные бактерии в разной степени устойчивы к действию тяжелых металлов. При этом скорость воздействия тяжелых металлов на грамположительные бактерии выше по сравнению с грамотрицательными. Процессы размножения патогенных микроорганизмов в среде в большей степени тормозят кадмий и кобальт, и в меньшей степени – свинец, что может быть связано с механизмами проникновения и воздействия тяжелых металлов на микробную клетку.



