Развитие клинической иммунологии в последние два десятилетия привело к накоплению огромного материала по оценке иммунного статуса при различных заболеваниях. Довольно широко в практике здравоохранения стал применяться термин вторичные иммунодефициты. Согласно Международной классификации болезней (X пересмотр), под термином «вторичный иммунодефицит» следует понимать нарушения иммунитета, возникающие в результате соматических и других болезней, а также прочих факторов [2]. К развитию вторичных иммунодефицитов могут приводить: несбалансированное питание, острый и хронический стресс, эндокринная патология, ятрогенные факторы (длительная терапия антибиотиками, цитостатиками, ГКС, иммунодепрессантами и т.п.), протозойные, бактериальные, вирусные инфекции, состояния после трансплантации органов и тканей, экологические факторы. злокачественные новообразования. Раковые опухоли могут также развиваться вследствие уже имеющегося иммунодефицита при воздействии канцерогенных агентов.
Вторичная иммунная недостаточность сопровождается, как правило, дисфункциями иммунной системы, проявляющимися изменениями процессов дифференцировки, пролиферации и взаимодействия ее клеток, приводящими к снижению иммунного ответа. В последние десятилетия наблюдается постоянный рост ВИН, способной осложнять течение любой патологии человека, ухудшать прогноз и резко снижать качество жизни [3].
Беременность сама по себе является физиологическим иммунодефицитным состоянием. У здоровой беременной женщины наблюдается пониженная устойчивость к инфекциям и обострение симптоматики аутоиммунных заболеваний. А беременность в состоянии приобретенного иммунодефицита отрицательно влияет на здоровье как матери, так и её потомства.
Цель исследования – изучить влияние иммунодефицитной беременности на анатомию и гистофизиологию тимуса потомства в условиях воздействия канцерогена и без него.
В качестве экспериментальной модели вторичного иммунодефицита было выбрано удаление селезенки. Работа выполнена на 60 белых нелинейных крысятах-самцах в возрасте 3 и 6 месяцев. Животные были разделены на 4 группы. Первая – крысята, родившиеся от здоровых самок, которым для контроля вводили изотонический раствор хлорида натрия. Вторая – крысята, родившиеся от здоровых самок, которым внутрибрюшинно вводили канцероген (1,2-диметилгидразин) из расчета 10 мг/кг 1 раз в неделю в течение четырех недель. Третья группа – крысята, родившиеся от самок на фоне спленэктомии, которым для контроля вводили изотонический раствор хлорида натрия. Четвертая группа – крысята, родившиеся от самок на фоне спленэктомии, которым внутрибрюшинно вводили канцероген (1,2-диметилгидразин) из расчета 10 мг/кг 1 раз в неделю в течение четырех недель.
Объектом исследования служил тимус. В работе использовались иммуногистохимические (с использованием антител к антигенам макрофагов (CD68), дендритных клеток (белок S-100), нейроэндокринных клеток АПУД-серии (синаптофизин и хромогранин А)), люминесцентно-гистохимические (методы Фалька-Хилларпа для идентификации серотонин- и катехоламинсодержащих структур и Кросса-Эвена-Роста для выявления гистаминсодержащих структур), общегистологические (окраска гематоксилином-эозином, окраска по методу Унна на тучные клетки) и статистические методы исследования.
В процессе исследования злокачественные новообразования были выявлены в обеих группах крысят с введением канцерогена, однако у крысят, родившихся от спленэктомированных крыс, клетки опухоли оказались менее дифференцированными, отдельные опухоли имели больший размер, и их количество достигало в отдельных случаях трех макроскопически видимых утолщений.
При анализе росто-весовых показателей было обнаружено, что крысята, родившиеся от спленэктомированных самок, отстают от своих ровесников. Так, масса крысят, родившихся от здоровых самок (1 и 2 группы) на обоих сроках превышает массу крысят, родившихся от спленэктомированных самок (3 и 4 группы), а крысята, которым вводили канцероген, отстают по массе от тех, которым вводили раствор хлорида натрия. Аналогичные изменения наблюдаются при подсчете абсолютной и относительной массы тимуса.
При морфометрическом исследовании тимуса было выявлено следующее. Дольки тимуса крысят от здоровых самок хорошо отличимы и разделены между собой соединительнотканными перегородками, в дольке визуализируется темное корковое вещество, расположенное на периферии, и более светлое мозговое вещество в центре. Дольки правильной округлой формы. При исследовании тимуса крысят, родившихся от спленэктомированных матерей, заметно смещение мозгового вешества в некоторых дольках на периферию. Дольки неправильной формы, вытянутые. Площадь мозгового вещества и толщина коркового вещества уменьшены в среднем на 35 % и 8 % соответственно в группе крыс, родившихся от спленэктомированных матерей с последующим введением канцерогена. На сроке 6 месяцев в тимусе крысят той же группы выявляется дальнейшее уменьшение этих показателей, наблюдается более выраженная деформация долек, замещение паренхимы жировой и соединительной тканью. У крысят, родившихся от здоровых самок, также выявляются признаки инволюции тимуса, но динамика этих изменений не так выражена.
При микроскопии тимуса крысят от здоровых самок на сроке 3 месяца в каждом поле зрения обнаруживается от 3 до 10 тучных клеток с преобладанием в их числе недегранулирующих и слабодегранулирующих клеток. У крысят, родившихся от спленэктомированных самок, с последующим введением канцерогена (4-я группа) на сроке 3 месяца также преобладают клетки с низкой степенью дегрануляции, однако общее число клеток в поле зрения больше и составляет от 7 до 17 клеток. Нами был подсчитан индекс дегрануляции по формуле Линднера [1]. ИД = А×0+Б×1+В×2+Г×3/n, где А – число неактивных клеток нулевой степени дегрануляции; Б – слабодегранулирующие тучные клетки, (1-ая степень); В – клетки с умеренной степенью дегрануляции, (2-ая степень); Г – клетки с сильной степенью дегрануляции, (3-я степень); n – общее число тучных клеток.
На сроке 6 месяцев индекс дегрануляции у здоровых крысят из первой группы повыщается незначительно, чего нельзя сказать об остальных исследуемых группах. В них наблюдается увеличение индекса на 20-30 %. При микроскопии обнаруживается большое число дегранулирующих тучных клеток в междольковых перегородках.
При сравнении люминесцентно-гистохимических препаратов тимуса крысят выявлено увеличение количества люминесцирующих гранулярных клеток (ЛГК) в тимусе крысят, родившихся от спленэктомированных крыс (3 и 4 группы). При окраске по Кроссу на гистамин выявляется картина звездного неба. В каждой группе нами было вычислено соотношение (серотонин+гистамин)/катехоламины, отражающее суммарно-направленное действие биогенных аминов [4]. На сроке 3 месяца по сравнению с первой группой в тимоцитах коркового и мозгового вещества оно несколько снижено у крысят, родившихся от спленэктомированных самок, и повышено в группах с введением канцерогена. На сроке 6 месяцев значение соотношения увеличивается, что говорит о подавлении функциональной активности тимуса. Причем в группе крысят, родившихся от спленэктомированных самок, с последующим введением канцерогена его увеличение более значительно.
Иммуногистохимические исследования показали, что большая часть клеток внутренней кортикальной, субкапсулярной зон и мозгового вещества у потомства интактных крыс дает положительную реакцию на белок S-100, что позволяет отнести их к дендритным клеткам. До 10-12 % клеток этих зон являются CD68-позитивными и содержат фермент лизоцим, проявляя тем самым свойства истинных макрофагов. 15-20 % ЛГК экспрессируют синаптофизин и дают положительную реакции на хромогранин А, т.е. относятся к клеткам АПУД-серии. У крысят опытных групп наблюдается увеличение количества клеток во всех зонах тимуса, особенно во внутренней кортикальной зоне в основном за счёт дендритных клеток и макрофагов (рис. 1, 2).
а 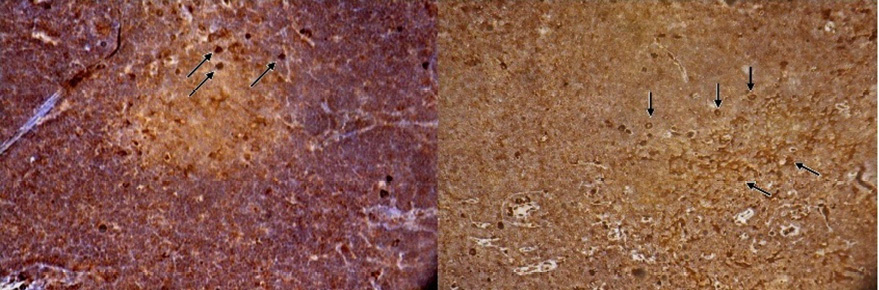 б
б
Рис. 1. Иммуногистохимическая реакция на белок S-100, ув.×100: а – долька тимуса крысенка, родившегося от здоровой крысы; б – долька тимуса крысенка, родившегося от спленэктомированной крысы. Стрелками указаны дендритные клетки
а 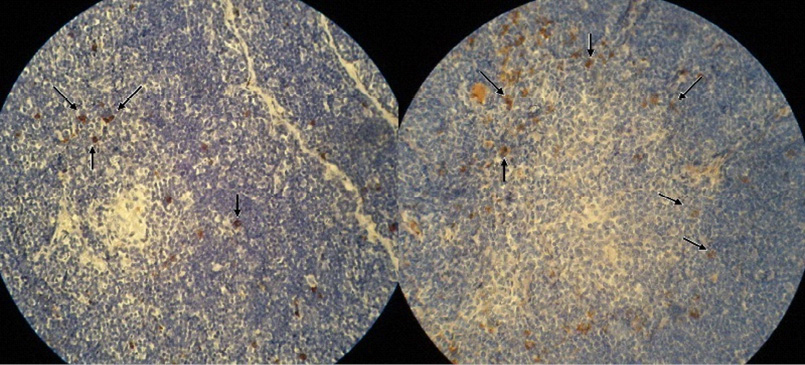 б
б
Рис. 2. Иммуногистохимическая реакция на CD-68, ув.×100: а – долька тимуса крысенка, родившегося от здоровой крысы; б – долька тимуса крысенка, родившегося от спленэктомированной крысы. Стрелками указаны макрофаги
Последние исследования ведущих авторов показали, что через плаценту от матери к ребенку способны проникнуть различные клетки, в т.ч. и иммунные. Это явление названо материнским иммунным импринтингом [5]. Он заключается в «наследовании» ребенком индивидуальных особенностей иммунного статуса матери, имевших место в период беременности. Благодаря ему новорожденный ребенок еще до встречи с повсеместно распространенными инфекционными агентами получает к ним определенную резистентность. Причем чем напряженнее специфический иммунитет матери, тем выше оказывается иммунорезистентность ее ребенка к тем же инфектам.
Выявленные нами морфофункциональные изменения в центральном органе иммуногенеза у потомства спленэктомированных крыс свидетельствуют о преждевременном развитии в нем инволютивных процессов, что проявляется в быстром уменьшении ее массы и объема, уменьшение площади мозгового и толщины коркового вещества. Увеличение количества клеток микроокружения, вероятно, говорит о напряженности иммунного ответа и участии клеток тимуса в этих процессах. В частности, тучные клетки, вероятно, принимают участие в замещении паренхимы тимуса соединительной тканью. Клетки АПУД-серии модулируют иммунный ответ посредством секреции биогенных аминов. Дендритные клетки мигрируют в тимус для активации процессов негативной селекции незрелых Т-лимфоцитов. Макрофаги фагоцитируют погибшие лимфоциты.
Таким образом, нами выявлено, что иммунодефицитная беременность самок серьезно сказывается на морфофункциональном состоянии тимуса крысят. Учитывая изменения, выявленные в ходе эксперимента, можно косвенно сказать, что удаление селезенки у крыс-самок приводит к развитию иммунодефицита у потомства. Воздействие канцерогенного фактора приводит к более выраженным негативным изменениям морфологического и функционального состояния клеток тимуса.



