Соединения шестивалентного хрома относятся к опасным загрязнителям окружающей среды, которые, обладая мутагенными, канцерогенными свойствами, входят в перечень потенциально опасных химических веществ по действию на репродуктивную функцию человека [6]. Высокий уровень хрома в крови, моче и других органах обнаружен у рабочих профессионально связанных с хромом. Шестивалентный хром (Cr VI) является одним из основных факторов риска в период полового созревания организма. Данные о влияние малых доз шестивалентного хрома на мужскую половую систему единичны и противоречивы. Это, по-видимому, связано с тем, что исследования, как правило, имеют однонаправленный характер: либо изучение гистоархитектоники семенников, либо изучение морфологических показателей сперматозоидов. Встречается незначительное число работ, когда в одном исследовании проводится сравнительный анализ морфофункционального состояния семенников с различными показателями сперматозоидов, и затем прогнозируется фертильность. Для прогнозирования возможности оплодотворения были разработаны различные так называемые индексы (показатели) плодовитости (фертильности), однако, все они носят относительный и условный характер. Следует отметить, что на сегодняшний день не существует ни одного теста, который бы предсказал с высокой точностью оплодотворяющий потенциал эякулята in vivo или in vitro, за исключением глубоких нарушений, в частности азооспермии. Несмотря на усилия, предпринимаемые Всемирной Организацией Здравоохранения (ВОЗ) для стандартизации исследований эякулята [5], все – таки сохраняется значительная вариация показателей спермограммы. Поэтому интегральным показателем состояния мужской генеративной функции служит оплодотворяющая способность сперматозоидов, а показателем генетических повреждений в половых клетках – метод учета доминантных летальных мутаций. Таким образом, при изучении действия химических соединений на репродуктивную функцию, особенно в малых дозах, необходим комплексный подход, т.е. помимо оценки морфофункционального состояния семенников, сперматозоидов учитывать частоту оплодотворения и выход доминантных летальных мутаций. Важным звеном в изучении механизмов повреждающего действия шестивалентного хрома на сперматогенный эпителий является определение функционального состояния клеточных мембран, которое зависит от процессов перекисного окисления липидов.
Цель исследования – провести количественный и морфологический анализ сперматогенного эпителия и сперматозоидов, провести оценку состояния перекисного окисления липидов в гонадах и выхода доминантных летальных мутаций у крыс, подвергнутых действию шестивалентного хрома (Cr VI) в малых дозах. На основании полученных результатов выявить механизмы действия шестивалентного хрома.
Материалы и методы исследования
Эксперименты были выполнены на 30 крысах-самцах с массой тела 230-260 г и 60 интактных самках линии Вистар. Моделирование хромовой интоксикации осуществлялось при субхроническом (48 дней) внутрибрюшинном введении бихромата калия (K2Cr2O7) в дозах 1/1000, 1/100 и 1/10 от ЛД50: (ЛД50 – 28 мг/кг массы тела), что составляет 0.028; 0.28; 2,8 мг/кг массы тела по веществу. Наибольшая из доз соответствует уровню порога острого действия по общетоксическим показателям, дозы 0.028 и 0.28 мг/кг в токсикологии считаются малыми дозами.
Животные были разделены на группы в соответствии с получаемой дозой: 1-я группа – 0.028 мг/кг, 2-я группа – 0.28 мг/кг и 3-я группа – 2.8 мг/кг. Животным контрольной группы вводили физиологический раствор. В конце экспозиционного периода животных умерщвляли путем цервикальной дислокации с соблюдением требований Международных принципов Хельсинской декларации о гуманном отношении к животным для экстирпации органов [9], затем были удалены семенники и хвостовая часть эпидидимиса. Определяли динамику изменения массы тела у контрольных и опытных животных, относительную массу семенников. Для цитологической оценки состояния сперматогенеза использовали мазки клеточного гомогената семенников [1].
Учитывали процентное соотношение отдельных типов сперматогенных клеток, митотический и мейотический индекс (количество митозов и мейозов на 1000 клеток, в ‰), патологические митозы (оценка 300 ана-телофаз), количество округлых сперматид с микроядрами. Сперматозоиды, извлеченные из хвостовой части эпидидимиса, подвергались количественной и морфологической оценке. Подсчет числа сперматозоидов в 1мл проводили в лейкоцитарном меланжере и камере Горяева с использованием физиологического раствора [5]. Определение процента патологических форм сперматозоидов проводили на мазках, фиксированных метиловым спиртом и окрашенных азур-эозином. Уровень перекисного окисления липидов в семенниках определяли по накоплению конъюгированных диенов [3] и малонового диальдегида [7], активность антиоксидантной системы – по подавлению Fe2+-зависимового окисления фосфолипидов желтка [2]. В конце экспозиционного периода самцов из каждой опытной и контрольной группы спаривали с девственными самками в стадии эструса (в соотношении 1:2). У самок на 19-20-й день беременности определяли: количество желтых тел в яичниках, число живых и мертвых эмбрионов. Учитывали процент беременных самок, общую эмбриональную смертность (желтые тела – живые эмбрионы/желтые тела х100) и постимплантационную гибель эмбрионов (отношение числа мертвых эмбрионов к сумме живых и мертвых эмбрионов х100) [8]. Для статистической обработки экспериментального материала использовали непараметрический тест Вилкоксона-Манна-Уитни и критерий χ2
Результаты исследования и их обсуждение
Вес животных после недельного карантина во всех группах стал примерно одинаковым (рис. 1). К концу экспозиционного периода прибавление в весе тела у животных контрольной группы составило 10 %, в первой группе – 6 %, во второй – 2 % и в третьей – 0 % (рис. 1а).
Относительный вес семенников не изменялся. Цитологический анализ препаратов семенников показал достоверно значимое (р< 0.05) снижение числа сперматоцитов во второй (0.28 мг/кг) и третье (2.8 мг/кг) группах, сперматид- во всех группах и сперматозоидов – в третье группе (рис. 1б). При всех исследуемых дозах наблюдалось снижение митотического и мейотического индексов (рис. 1в). При всех исследуемых дозах наблюдалось увеличение числа округлых сперматид с микроядрами (р< 0.05) и числа патологических форм сперматозоидов (р< 0.05), значимо возрастал процент аномальных митозов, отмечалось наличие многоядерных сперматид (рис. 1в, г; рис. 2 А, Б).
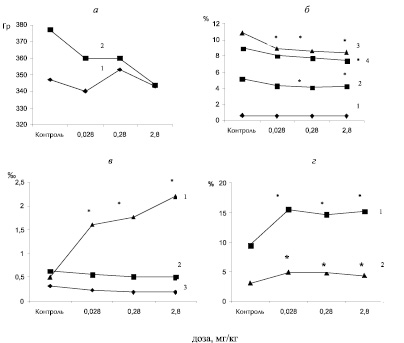
Рис 1. Изменение веса тела, количественные и морфологические изменения сперматогенного эпителия через 48 суток после внутрибрюшинного введения бихромата калия в разных дозах: а – вес тела до введения (1), после введения (2); б – число сперматогоний (1), сперматоцитов (2), сперматид (3), сперматозоидов (4); в – число округлых сперматид с микроядрами (1), число мейозов (2), число митозов (3); г – число патологических митозов (1), число патологических сперматозоидов (2). * р <0.05 в сравнении с контролем
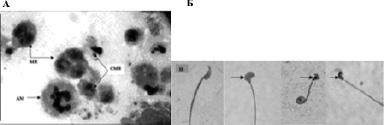
Рис 2. Морфологическая характеристика сперматогенных клеток (А) и сперматозоидов (Б) после воздействия бихромата калия. Окрашивание азур эозином, х 960 (А), х 600 (Б). А – аномальные митозы (АМ), микроядра в сперматидах (СМЯ), многоядерные сперматиды (МЯ). Б – нормальный сперматозоид (Н), сперматозоиды с аномальной головкой (обозначены стрелкой)
Количество эпидидимальных сперматозоидов составило при дозе 0.028 мг/кг – 37.9 тыс./мл, при 0.28 мг/кг – 36.1 тыс./мл, при 2.8 мг/кг – 35.5 тыс./мл против 46.9 тыс./мл в контроле, разница не значима. У животных во всех опытных группах значимо возрастала концентрация диеновых конъюгатов (ДГ), а у крыс 3-й группы – и содержание малонового диальдегида (МДА), наблюдается тенденция к подавлению активности антиоксидантной системы (табл. 1).
Таблица 1
Показатели перекисного окисления липидов в семенниках крыс при воздействии бихромата калия в разных дозах (М ± м). * – достоверно значимые различия при р<0,05
|
Показатели нмоль/г ткани |
Контроль |
Доза бихромата калия |
||
|
0,028 мг/кг |
0,28 мг/кг |
2,8 мг/кг |
||
|
ДК МДА АОА, усл.ед. |
6,950 ± 0,172 3,622 ± 0,136 0,40 ± 0,06 |
8,281 ± 0,868* 3,942 ± 0,566 0,28 ± 0,06 |
7,618 ± 0,324* 3,836 ± 0,210 0,025 ± 0,04 |
7,764 ± 0,280* 3,962 ± 0,224* 0,30 ± 0,03 |
Анализ доминантных летальных мутаций при всех исследуемых дозах показал достоверно значимое увеличение общей эмбриональной смертности, которая происходит в основном за счет постимплантационных потерь (табл. 2).
Таблица 2
Результаты доминантно-летального анализа у крыс при воздействии различных доз бихромата калия
|
Показатели |
Группа |
|||
|
Контроль |
1 |
2 |
3 |
|
|
Число беременных самок, % Среднее число на самку: желтых тел живых эмбрионов мертвых эмбрионов Общая эмбриональная смертность, % Доимплантационные потери, % постимплантационные потери, % |
85 12.2 ± 0.41 ± 0.52 ± 0.02 24.5 20.5 5.1 |
72 11.0 ± 0.52 6.5 ± 0.81* 1.8 ± 0.31* 37.5* 24.5 21.6.* |
77 11.3 ± 0.35 ± 0.85* 1.4 ± 0.22* 38.1* 25.6 16.7* |
75 11.2 ± 0.33 7.1 ± 0.80* 1.2 ± 0.25* 35.5* 25.8 14.5* |
*Достоверно значимые различия с контролем при р<0,05.
Уменьшение числа герминативных клеток, возможно, обусловлено как их гибелью в результате токсического действия хрома, так и блоком митозов и мейозов. Снижение числа сперматогенных клеток в семеннике приводит к падению количества эпидидимальных сперматозоидов. Увеличение числа сперматид с микроядрами и процента аномальных митозов способствует возрастанию патологических форм сперматозоидов и как следствие – снижение оплодотворяющей способности, рост эмбриональной смертности. Эмбриональные потери могут быть как до, так и после имплантации. Основным показателем мутагенного действия химических воздействий служит постимплантационная гибель [4]. При снижении вводимой дозы бихромата калия мутагенный эффект усиливается за счет того, что половые клетки не гибнут и сохраняют способность к оплодотворению.
Заключение
Анализ полученных данных позволяет заключить, что действие Cr VI даже в относительно невысоких дозах приводит к нарушению гаметогенеза. При наибольшей из исследуемых доз изменения в репродуктивнойфункции обусловлены токсическими свойствами Cr VI, а при наименьшей дозе – мутагенным эффектом. Накопление в половых клетках перекисных продуктов оказывает влияние на процессы мейоза , возможно воздействуя на ДНК клетки, тем самым вызывая в них мутационные изменения, что приводит к увеличению патологических сперматозоидов и как следствие – гибели плодов.
Работа выполнена при финансовой поддержке программы научных исследований УрО РАН (№12-С-4-1012, № 12-П-4-1068).



