В настоящее время одним из перспективных направлений развития биотехнологии является поиск новых источников получения эфирных масел и витаминов, обладающих ценными фармакологическими эффектами. Использование продуцентов биологически активных соединений требует детального исследования их культурально-морфологических, физиолого-биохимических особенностей, основных биотехнологических показателей для прогнозирования стабильности культуры в производстве и дальнейшего внедрения в фармацевтическую промышленность.
На основе проведенных раннее исследований с культурами микроскопических грибов представляется особо важным дальнейшее изучение и внедрение в производство Eremothecium ashbyi, Eremotecium gossypii (syn. Ashbya gossypii, Nematospora gossypii) в качестве продуцентов рибофлавина и эфирного масла, аналогичного составу розового масла, являющихся ценными натуральными веществами и находящими применение в бытовой химии, парфюмерии, косметике, медицине, а также в пищевой промышленности [13].
Целью данного исследования является проведение анализа литературных источников, касающихся биотехнологического сырья и препаратов на его основе, и выявление основных этапов технологических процессов с использованием Eremothecium.
Материалы и методы исследования
В работе использован контент-анализ научной литературы, содержащей информацию о биотехнологическом сырье, технологиях получения рибофлавина и ароматических продуктов на его основе, а также официальных источников информации о препаратах, зарегистрированных в Минздраве РФ и разрешенных к медицинскому применению [7, 11].
Результаты исследования и их обсуждение
Рибофлавин (витамина В2) является важным элементом в нормальном функционировании человеческого организма, участвует в окислительно-восстановительных процессах. В организме рибофлавин фосфорилируется, превращаясь в коферменты – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД), входит в состав основных дыхательных ферментов, с помощью которых осуществляется тканевое дыхание. В природе продуцентами витамина В2 являются высшие растения, дрожжи, мицелиальные грибы и бактерии. Большинство микроорганизмов, в том числе микроскопические грибы, образуют свободный рибофлавин и две его коферментные формы ФМН и ФАД. Основной формой флавинов, выделяемых грибами в среду, является рибофлавин. Как правило, витамин В2 образуется микроорганизмами в больших количествах, чем нужно для удовлетворения потребности клетки в этом витамине. Применение большинства микроорганизмов в промышленных целях позволяет получать биотехнологическое сырье с высоким содержанием витамина.
Среди плесневых грибов наиболее активные продуценты рибофлавина – Aspergillus niger и другие виды этого рода (табл. 1). Использование мицелия грибов как источника флавинов экономично, поскольку мицелий является отходом антибиотической промышленности [10, 54].
Таблица 1
Микромицеты – продуценты рибофлавина
|
Микроорганизм |
Таксономическое положение (царство, класс, отдел, семейство) |
Источник информации |
|
Candida farmata |
Fungi, Ascomycota, Hemiascomycetes, Saccharomycetaceae |
[50, 54] |
|
Pichia guilliermondii |
Fungi, Ascomycota, Hemiascomycetes, Saccharomycetaceae |
[28] |
|
Eremothecium ashbyi |
Fungi, Ascomycota, Hemiascomycetes, Eremotheciaceae |
[13, 53] |
|
Eremothecium gossypii |
Fungi, Ascomycota, Hemiascomycetes, Eremotheciaceae |
[13, 53] |
|
Aspergillus niger |
Fungi, Ascomycota, Eurotiomycetes, Trichocomaceae |
[53] |
У флавиногенных дрожжей индукция рибофлавина происходит при депрессии по железу. Среди представителей семейства Saccharomycetaceae продуцентами витамина В2 являются Candida famata [50, 53, 54], Pichia guilliermondii [20, 28].
Аскомицеты Eremothecium gossypii, Eremothecium ashbyii являются активными продуцентами рибофлавина, могут накапливать от 2480 до 6420 мг рибофлавина в 1 л культуральной жидкости [10, 25, 32, 37, 39, 56].
По имеющимся данным, касающихся биохимической активности продуцентов, химическая природа субстрата и тип катализируемой реакции определяются способностью микроорганизмов к проявлению тех или иных признаков в соответствующих условиях среды, так как характер ферментов, которые микромицеты продуцируют и выделяют во внешнюю среду, существенно различается; другими словами, уровень активности сахаролитических, протеолитических и окислительно-восстановительных ферментов, активирующих соответственно расщепление углеводов и белков, неодинаков и является видоспецифичным (например, E. ashbyii и E. gossypii имеют разную способность к утилизации таких полисахаридов, как крахмал и целлюлоза, к восстановлению нитратов [16, 17, 46]). В ранее проведенных исследованиях по изучению синтеза рибофлавина E. gossypii и E. ashbyii в зависимости от природы субстратов питательных сред максимальные уровни специфического роста и продукции рибофлавина наблюдались на средах, содержащих как глюкозу, так и подсолнечное масло в качестве субстратов. Хотя более высокая продукция рибофлавина была отмечена у E. ashbyii на среде, имеющей в составе молочную сыворотку, по сравнению со средой с глюкозой, но более низкие показатели достигались у E. gossypii при одинаковых экспериментальных условиях. Это возможно обусловлена тем, что сыворотка в основном состоит из лактозы и уровень ассимиляции дисахарида E. gossypii ниже, чем глюкозы [16, 17, 27, 40, 42].
Динамика накопления вторичного метаболита – рибофлавина культурой E. аshbyii в жидких питательных средах, различающихся компонентным составом, представлена на рис. 1. Содержание рибофлавина сохраняет тенденцию к увеличению с возрастанием рН независимо от состава среды и достигает достаточно высоких показателей. Влияние ионов К+ и Na+ на показатели продуктивности были изучены в специальных опытах с использованием разных по составу сред, но с одинаковым начальным значением pH. Добавление в среду ионов К+, в отличие от варианта с добавлением Na+, стимулирует продуктивность микромицета, кроме синтеза рибофлавина. При этом не только количество, но и соотношение ионов влияет на продуктивность культуры. Через двое суток роста происходит подкисление среды, причем в большей степени в присутствии ионов К+. Вероятно, подкисление среды обусловлено выбросом клетками ионов Н+ [2, 18, 19, 33]. Кроме того, было показано, что повышение концентрации фосфатов в питательной среде с 0,0015 мМ до 150 мМ увеличивало рост продуцента до 70 %, но снижало накопление флавинов в бульоне до 60 %. Однако, в это же самое время величина общей концентрации продуцированных флавинов во время роста (специфические флавины) снизилась до 80 %. Причем интересно отметить, что соотношение рибофлавина к флавиномононуклеотиду уменьшилось в 7 раз. Ингибирование синтеза рибофлавина может быть связано с ингибированием повышенной концентрацией фосфатов гуанозинтрифосфат-циклогидролазы, которая катализирует первый этап биосинтеза рибофлавина [36].
Примечательно, что время конверсии субстрата в рибофлавин в мицелии может быть продлено с целью улучшения продукции рибофлавина. Это может быть достигнуто при добавлении минеральной поддержки (AID PLUS ML-50D, Niigata, Japan). В культуре без нее наблюдались единичные гифы при 108-часах. Этот мицелий был автолизован или пустым внутри. При 120 часах культивирования без минеральной поддержки не наблюдалось ни мицелия, ни интрацеллюлярного рибофлавина. Единственной возможной причиной этого различия может быть электронный заряд минеральной поддержки. В ее присутствии мицелий возможно более стабилен, и продукция рибофлавина может быть продлена [31].
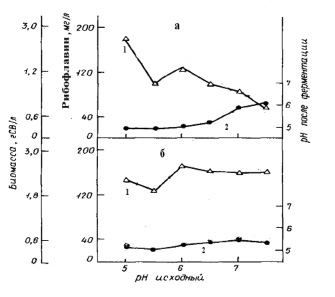
Рис. 1. Динамика накопления рибофлавина и биомассы при глубинном культивировании E. аshbyii (по Бугорский П.С., Семенова Е.Ф., Родов В.С., 1990): а – среда №2; б – среда №1 с 0,5 г/л гидрофосфата калия, 1 – биомасса; 2 – рибофлавин
Кроме того, максимальный уровень синтеза рибофлавина в культуре E. gossypii может быть достигнут при добавлении тиамина в глюкозную питательную среду. Добавление тиамина, инозитола и биотина в среды, содержащие глюкозу или молочную сыворотку, увеличивало уровень специфического роста до 34 % и 97 %, соответственно. Скорость роста и продукция рибофлавина, напротив, снижались на средах, содержащих и факторы роста, и подсолнечное масло [41].
На рис. 2 представлены основные технологические процессы получения рибофлавина при использовании представителей рода Eremothecium в качестве продуцента [9].
Что касается эфирных масел, широко распространенных в растительном мире, от грибов и водорослей до цветковых растений, то к настоящему времени для производственных целей используется лишь сравнительно небольшое число видов высших растений [43]. Качество эфирного масла существенно зависит от экологических факторов, местности, в которой выращиваются эфироносы, кроме того плантационное выращивание характеризуется сезонностью. Указанных недостатков лишено биотехнологическое производство.
Однако биотехнологии получения эфирных масел в культуре изолированных клеток и тканей не являются конкурентоспособными по сравнению с биотехнологиями на основе микробного синтеза [55], поэтому особый интерес в качестве нетрадиционных источников эфирных масел и ароматических веществ представляют бактерии, дрожжи, актиномицеты, грибы, водоросли, способные как синтезировать эти субстанции de novo, так и биоконвертировать их из менее ценных компонентов (жирные кислоты, спирты, алканы и др.).
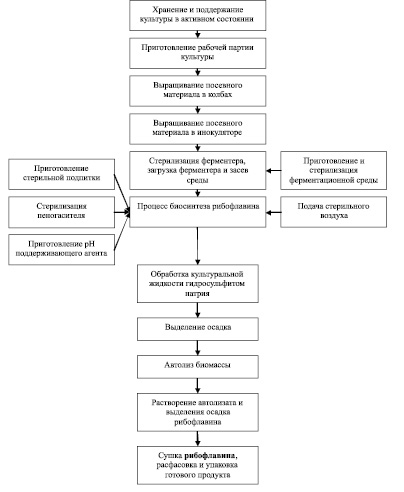
Рис. 2. Блок-схема получения рибофлавина на основе Eremothecium (по Дуган А.М. с сотр., 2011)
В проведенных ранее исследованиях было начато изучение новых природных источников душистых веществ. Оценка проводилась по уровню накопления и составу эфирного масла, скорости роста культуры и другим свойствам, важным для биотехнологического производства [13, 15, 29, 30, 35]. Кроме этого, особое внимание уделяется исследованию механизмов синтеза ароматообразующих соединений, выяснению путей метаболизма, влияющих на этот процесс [12, 13, 15, 29, 30, 35].
Среди изученных представителей дрожжей (роды Saccharomyces, Endomycopsis) выявлены штаммы, продуцирующие ароматобразующие вещества в количестве до 95 мг/л (табл. 2). Как правило, у этих культур в состав ароматических продуктов входит β-фенилэтанол. По сравнению с другими группами микроорганизмов они обладают самой большой скоростью роста, что дает преимущество в связи с увеличением выхода целевого продукта на единицу полезного объема оборудования [21].
Осуществленный направленный поиск перспективных объектов для биотехнологии ароматических продуктов в пределах родов Trichoderma, Ceratocystis, Aspergillus, Eremothecium дал возможность охарактеризовать различия между видами, штаммами по уровню биосинтетической активности и составу эфирного масла [22]. Синтез эфирного масла E.ashbyi достигает 180 мг/л культуральной жидкости в течение первых двух суток роста на ферментационной среде, что может быть сопоставлено с содержанием эфирного масла в 500-600 г цветков розы [3, 13]. Основными компонентами эфирного масла являются гераниол, β-фенилэтанол, а также идентифицированы нерол, цитронеллол, нераль и гераниаль [3, 8]. По составу эфирное масло, синтезируемое E.ashbyi, приближается к эфирному маслу свежих цветков розы и обладает приятным запахом. Компонентный состав эфирного масла E. gossypii сходен, но соотношение монотерпеновых спиртов более приближено к их содержанию в болгарском розовом масле [3]. Этот натуральный продукт, цена которого на мировом рынке достигает 80$ за 1 грамм, чрезвычайно востребован. Ведь более 50 % мировых парфюмерных брендов изготавливается на основе розового масла. Оно также используется в медицине и фармацевтике. Розовое масло обладает умеренным антибактериальным (бактериостатическим) действием, при этом β-фенилэтанол ингибирует синтез макромолекул, но не токсичен в равной степени для всех микроорганизмов и штаммов [13, 51]. Показана его эффективность против широкого спектра бактерий, грибов, вирусов, повышение на их фоне чувствительности возбудителей к антибактериальным средствам. Масло применяют в качестве корриганта фармацевтических препаратов с целью улучшения их вкуса и запаха. Розовое масло регулирует работу надпочечников, оказывает жаропонижающее, противовоспалительное, противоотечное, желчегонное, гепатопротекторное действие, применяется в лечении стоматита, пародонтоза, кожных и других заболеваний [6]. Эфирное масло оказывает также стимулирующее или успокаивающее действие на центральную нервную систему, проявляет иммуномодулирующий эффект, регулирует окислительные процессы в организме [24, 38].
Основные технологические процессы получения эремотецевого масла показаны на рис. 3 [1, 49]. С целью получения более чистого, качественного конечного продукта необходимо введение дополнительных методов очистки синтезируемого эфирного масла от побочных веществ, что также учтено в представленной схеме.
Выход розового масла составляет в среднем 0,025 %, так что для получения 1 кг масла приходится собрать вручную и переработать около 4 тонн лепестков. После перегонки масла остается розовая вода. В ней доля масла составляет около 0,2 %. Основным поставщиком розовой воды на мировой рынок является Иран. Однако масло в Иране не производят [44]. В мире производят розовое масло высшего качества (объем которого в настоящее время около 600 кг/год) всего 4 страны: Саудовская Аравия (город Таиф), Болгария (Казанлык), Турция (Стамбул) и Узбекистан (Ташкентская область) [23, 26, 34, 45, 52].
До 1992 года производство розового масла методом гидродистилляции в республиках СССР (Украина, Молдавия и др.) составляло около 4 т/год. Сейчас оно резко сократилось из-за экономического кризиса в странах СНГ [4]. Например, в 2005 г. В Крыму было выработано 600 кг эфирного масла (экстракта) розы, что в 2 раза меньше по сравнению с максимально достигнутыми эфиромасличной отраслью этого региона показателями [5].
Использование штаммов рода Eremothecium позволяет получать как эфирное масло, так и рибофлавин, поэтому может быть предложена следующая комплексная технологическая блок-схема (рис. 4), существенно повышающая рентабельность биотехнологического производства.
Таблица 2
Микромицеты – продуценты летучих соединений
|
Микроорганизм |
Таксономическое положение (царство, отдел, класс, семейство) |
Компонентный состав ароматического продукта |
Источник информации |
|
Saccharomyces sp. |
Fungi, Ascomycota, Hemiascomycetes, SaccharomycetaceaeHYPERLINK «http://bvi.rusf.ru/taksa/s0020/s0020298.htm» |
β-фенилэтанол |
[21] |
|
Kluyveromyces lactis |
Fungi, Ascomycota, Hemiascomycetes, SaccharomycetaceaeHYPERLINK «http://bvi.rusf.ru/taksa/s0020/s0020298.htm» |
цитронеллол, гераниол, линалоол, β-фенилэтанол, эфиры |
[35] |
|
Endomycopsis sp. |
Fungi, Ascomycota, Hemiascomycetes, Endomycetaceae |
β-фенилэтанол |
[21] |
|
Eremothecium ashbyi |
Fungi, Ascomycota, Hemiascomycetes, Eremotheciaceae |
гераниол, β-фенилэтанол |
[13] |
|
Eremothecium gossypii |
Fungi, Ascomycota, Hemiascomycetes, Eremotheciaceae |
гераниол, β-фенилэтанол |
[13] |
|
Aspergillus foetidus |
Fungi, Ascomycota, Eurotiomycetes, Trichocomaceae |
лактоны, терпеновые и ароматические спирты, альдегиды, кетоны |
[14] |
|
Aspergillus niger |
Fungi, Ascomycota, Eurotiomycetes, Trichocomaceae |
метилкетоны, пиразины |
[14] |
|
Penicillium canescens |
Fungi, Ascomycota, Eurotiomycetes, Trichocomaceae |
лактоны, терпеновые и ароматические спирты, альдегиды, кетоны |
[14, 30] |
|
Ceratocystis paradoxa |
Fungi, Ascomycota, Sordariomycetes, Ophiostomataceae |
лактоны, терпеновые и ароматические спирты, альдегиды, кетоны |
[35] |
|
Ceratocystis fimbriata |
Fungi, Ascomycota, Sordariomycetes, Ophiostomataceae |
ацетальдегид, изопропанол, этилацетат, этилизобутират, изобутилацетат, изоамилацетат, этил-3гексаноат |
[29, 35] |
|
Trichoderma viride |
Fungi, Ascomycota, Sordariomycetes, Hypocreaceae |
лактоны, терпеновые и ароматические спирты, альдегиды, кетоны |
[30, 35] |
|
Ceratocystis pilifera |
Fungi, Ascomycota Sordariomycetes, Ophiostomataceae |
лактоны, терпеновые и ароматические спирты, альдегиды, кетоны |
[35] |
|
Ischnoderma benzoinum |
Fungi, Basidiomycota, Agaricomycetes, Polyporaceae |
бензальдегид,4-метоксибензальдегид |
[35] |
|
Pycnoporous cinnabarinus |
Fungi, Basidiomycota, Agaricomycetes, Polyporaceae |
ванилин, метилантранилат |
[35] |
|
Lentinus edodes |
Fungi, Basidiomycota, Agaricomycetes, Polyporaceae |
лентиноин, 1-октен-3-ол, 1-октен-3-он |
[35] |
|
Wolfiporia cocos |
Fungi, Basidiomycota, Agaricomycetes, Polyporaceae |
линалоол |
[30, 35] |
|
Mycena pura |
Fungi, Basidiomycota, Agaricomycetes,Thicholomataceae |
цитронеллол |
[35] |
|
Poluporus tuberaster |
Fungi, Basidiomycota, Agaricomycetes, Polyporaceae |
метилбензоат, этилбензоат, летучие вещества дубового мха |
[35] |
|
Rhisopus arrhizus |
Fungi, Zygomycota Zygomycetes, Mucoraceae |
эфиры длинноцепочечных жирных кислот |
[14] |
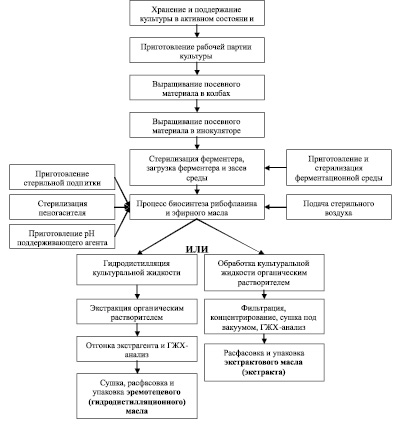
Рис. 3. Разработанная блок-схема основных технологических процессов получения эфирного масла на основе Eremothecium
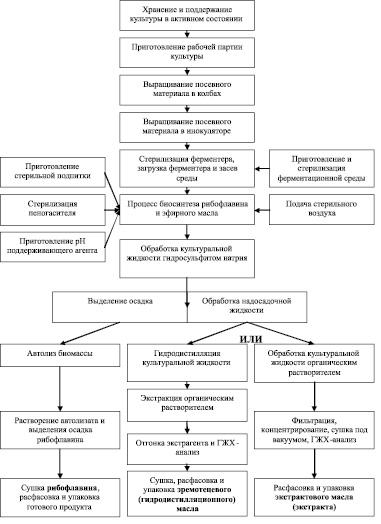
Рис. 4. Предлагаемая блок-схема комплексной биотехнологии эфирного масла и рибофлавина на основе Eremothecium
Анализ разрабатываемых ароматических продуктов и технологий на основе Eremothecium дает основание полагать, что их использование может осуществляться по следующим направлениям (рис. 5).
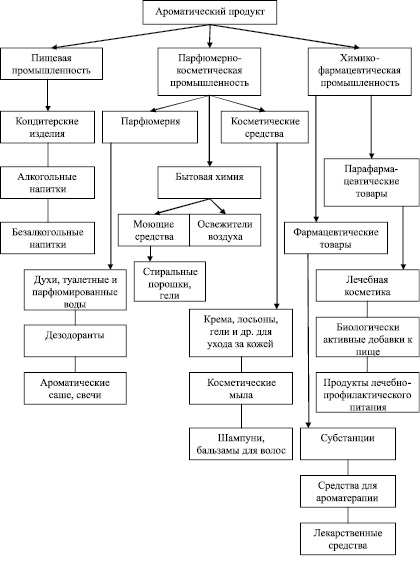
Рис. 5. Направления использования ароматического продукта, получаемого на основе Eremothecium
Заключение
Представители рода Eremothecium являются перспективными продуцентами как рибофлавина, так и эфирного масла, что обусловливает необходимость в дальнейшей разработке биотехнологий [46-48]. Экономическая целесообразность производства на основе эремотеция может быть увеличена за счет применения технологии комплексного получения биологически активных веществ для удовлетворения потребности в них химико-фармацевтической, косметической, пищевой промышленности.



