Когнитивные нарушения достаточно часто сопровождают острую и хроническую сосудистую патологию головного мозга. Для их диагностики используют критерии, разработанные R. Petersen (1999): 1) снижение памяти (как со слов пациента, так и по мнению окружающих); 2) отсутствие ограничений в повседневной жизни; 3) сохранность высших корковых функций в целом; 4) снижение когнитивной функции по сравнению с возрастной нормой (по данным психологического тестирования); 5) отсутствие деменции [3, 6].
Лечение мнестических расстройств, несмотря на широкий спектр лекарственных препаратов, предлагаемых фармацевтическим рынком, представляет достаточно сложную задачу. Установлено, что большинство ноотропных (ноотропил, пирацетам) и метаболических (церебролизин) препаратов действуют преимущественно при расстройствах памяти «подкоркового» характера, при корковых деменциях альцгеймеровского типа наибольший эффект оказывают ингибиторы ацетилхолинэстеразы (амиридин, ривастигмин, галантамин) [8, 9].
Учитывая многокомпонентность патогенеза когнитивных расстройств при нарушениях мозгового кровообращения, в том числе большую роль микроциркуляторных и гемореологических изменений, ведется поиск новых путей их коррекции. Для реализации этого подхода был предложен винпоцетин, который не только действует на метаболизм ишемизированной ткани мозга, но и улучшает регионарный кровоток, микроциркуляцию и гемореологию в патологическом очаге [2].
В настоящее время одной из базовых задач фармацевтической технологии является разработка новых лекарственных форм, в том числе с различными системами доставки лекарственных веществ, с использованием уже известных лекарственных средств.
Несмотря на увеличивающийся поиск альтернативных способов введения и методов доставки лекарственного вещества пероральные лекарственные формы остаются наиболее популярными и удобными для пациента. Для данного пути введения более всего подходят твердые лекарственные формы, что связано с отработанной технологией и высокой точностью дозирования [1].
Одной из наиболее современных форм, в которые вводят действующие вещества с целью их оптимальной доставки, пролонгирования, защиты от внешних неблагоприятных воздействий являются микрокапсулы. Терапевтическая эквивалентность микрокапсул возрастает в связи с тем, что с помощью относительно несложных технологических приемов удается не только получать микрокапсулы с оболочкой равной толщины, но и регулировать толщину оболочки в зависимости от целей и стратегии медикаментозной терапии. Микрокапсулирование играет важную роль, когда идет речь о лекарственных веществах, оказывающих свое терапевтическое действие в достаточно малых количествах [4]. Именно таковым является лекарственный препарат винпоцетин, применяемый в дозировке 0,005-0,01 г.
Целью исследования является проведение качественного и количественного анализа винпоцетина в разработанной лекарственной форме винпоцетина – микрокапсулах.
Материалы и методы исследования
Методом диспергирования были получены микрокапсулы винпоцетина [5].
Для подтверждения содержания винпоцетина в микрокапсулах использовали инфракрасную спектроскопию на оборудовании Vertex 70, непосредственно в разработанной лекарственной форме. Для этого проводили измерение величин светопропускания образцов с помощью многофункционального ИК-спектрофотометра Инфралюм ФТ-08 с приставкой MI Racle Single Reflection Horizontal ATR Accessory в диапазоне 4000-400 см-1. Полученный спектр зависимости величины светопропускания от волнового числа сравнивали со спектром стандартного образца.
Сравнение ИК-спектров стандартного образца и субстанции винпоцетина дало возможность свидетельствовать об идентификации субстанции винпоцетина в микрокапсулах. ИК-спектр субстанции и микрокапсул винпоцетина в области 4000 – 400 см–1 имеют полосы поглощения при 1720, 1607, 1680 см -1.
Приготовление раствора стандартного образца винпоцетина. 0,02 г (точная навеска) винпоцетина помещали в мерную колбу вместимостью 50 мл, растворяли в 10 мл смеси 0,1 М раствор кислоты хлористоводородной – спирт этиловый 95 % (1: 9), доводили объем раствора той же смесью до метки и перемешивали. 3 мл полученного раствора переносили в мерную колбу вместимостью 50 мл, доводили объем раствора смесью 0,1 М раствор кислоты хлористоводородной – спирт этиловый 95 % (1: 9) до метки и перемешивали. Измеряли оптическую плотность полученного раствора на спектрофотометре СФ – 2000 при длине волны 314 нм в кювете с толщиной слоя 10 мм.
Приготовление раствора анализируемой лекарственной формы. С этой целью предварительно измельчив 0,3 г микрокапсул винпоцетина, поместили в мерную колбу вместимостью 50 мл, растворяли в 10 мл смеси 0,1 М раствор кислоты хлористоводородной- спирт этиловый 95 % (1: 9), доводили объем раствора той же смесью до метки и перемешивали. 3 мл полученного раствора переносили в мерную колбу вместимостью 50 мл доводили объем раствора смесью 0,1 М раствор кислоты хлористоводородной – спирт 95 % (1: 9) до метки и перемешивали. Измеряли оптическую плотность полученного раствора на спектрофотометре СФ – 2000 в максимуме поглощения при длине волны 314 нм в кювете с толщиной слоя 10 мм.
Разработка методики количественного определения. 0,05 г (точная навеска) РСО винпоцетина (раствор А) переносили в мерную колбу вместимостью 50 мл, растворяли в 10 мл смеси 0,1 М раствор кислоты хлористоводородной – спирт этиловый 95 % (1: 9), доводили объем раствора той же смесью до метки и перемешивали.
Для построения градуировочного графика использовали ряд разведений раствора А. В результате получили растворы винпоцетина с концентрацией винпоцетина 0,001, 0,002, 0,003, 0,004, 0,006 г/100мл. Оптическую плотность растворов измеряли на спектрофотометре СФ -2000 при длине волны 314 нм.
Результаты исследования и их обсуждение
Результат экспериментального исследования представлен на рис. 1.
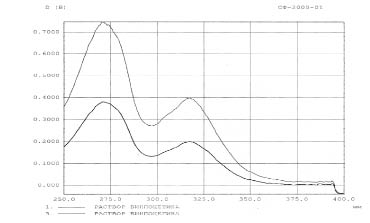
Рис. 1. Спектр поглощения раствора винпоцетина стандартного образца и в разработанной лекарственной форме
Полученный характер спектров РСО винпоцетина и раствора разрабатываемой лекарственной формы идентичны, а также имеют одинаковое положение максимумов светопоглощения, что позволяет использовать данную методику для определения подлинности винпоцетина в лекарственной форме.
Изучение влияния сопутствующих компонентов лекарственной формы на определение винпоцетина.
В лабораторных условиях были получены микрокапсулы плацебо, которые анализировали по описанной выше методике. Результаты представлены на рис. 2.
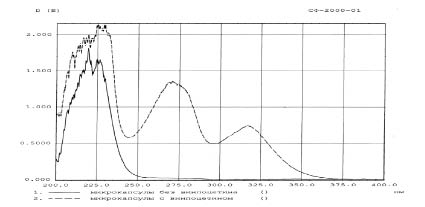
Рис. 2. Спектр поглощения лекарственной формы с винпоцетином плацебо
Как видно из рисунка, у микрокапсул без винпоцетина отсутствует максимум в области 275 и 314 нм, следовательно вспомогательные вещества не мешают определению винпоцетина, т.е. не искажают результаты определения.
В ходе выполнения исследований были получены следующие результаты (рис. 3.)
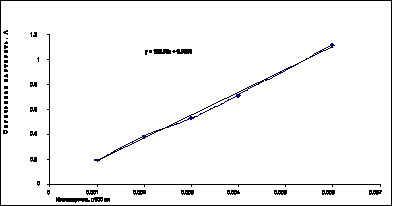
Рис. 3. Градуировочный график зависимости оптической плотности от концентрации стандартного образца винпоцетина
В данной области концентраций график имел линейный характер. Уравнение графика было следующим у=182,6х + 0,0029. Коэффициент корреляции составил 0,998528, что позволяет использовать данный график для расчета количественного содержания винпоцетина в разработанной лекарственной форме.
Определение содержания винпоцетина в разработанной лекарственной форме проводили по описанной методике (качественное определение винпоцетина), расчет выполняли по уравнению градуировочного графика, как среднее из двух параллельных определений. В результате содержание винпоцетина составило 0,01 г ±0,00053.
Выводы
Суммируя данные проведенных исследований по изучению возможности качественного и количественного определения винпоцетина в микрокапсулах, можно сделать заключение, что смесь 0,1 М раствор кислоты хлористоводородной – спирт этиловый 95 % (1: 9) возможно использовать для проведения количественного анализа винпоцетина в микрокапсулах методом спектрофотометрии.



