Интерес ученых к химической трансформации природных алкалоидов, углеводов и др. не ослабевает и по сегодняшний день. Это обусловлено прежде всего их высокой биологической активностью. Вмешиваясь в структуру природных соединений, синтезированных самой природой, человек создает новые, порой уникальные химические соединения, которые во многих аспектах оказываются в десятки раз более эффективными и менее токсичными биоактивными соединениями, чем исходные субстраты и уже широко применяются в качестве лекарственных препаратов.
Одним из перспективных синтонов в плане модификации и поиска новых биоактивных веществ является известный алкалоид – анабазин, который обладает сильными инсектицидным и противотуберкулезным свойствами и все еще полностью не раскрытими потенциальными перспективами [6]. Поиск новых его синтетических производных с потенциально антибактериальной активностью возможен путем введения в его структуру таких фармакофорных фрагментов, как тиомочевинный, фурановый, тиазолиновый и др., которые являются структурными звеньями многих антибактериальных препаратов, используемых в медицинской практике [3,5].
Для синтеза соединений с базовым тиазольным, тиазолиновым или тиазолидиновым кольцом помимо прямого введения реакцией алкилирования галогенацетильными замещенными производными тиазолов, довольно часто применяются изотиоцианатные, тиоамидные и тиомочевинные производные [8], которые не только являются удобными синтонами для их получения, но и в зависимости от других реагентов и условий, позволяют подробно изучить механизмы возможной гетероциклизации.
Цель исследования. Осуществление реакции синтеза новых тиомочевинных, тиазолиновых и тиазиновых производных алкалоида анабазина, изучение их строения и биологических свойств на наличие антибактериальной и противогрибковой активности.
Материалы и методы исследования
ИК-спектры сняты на спектрометре с Фурье-преобразователем AVATAR-320 в таблетках с KBr, спектры ЯМР 1Н записаны на спектрометре Bruker DRX 500 (500 МГц) в растворе DMSO-d6 относительно внутреннего стандарта ТМС. Рентгеноструктурный анализ проведен на четырехкружном автоматическом дифрактометре Xcalibur.
Изучение антибактериальной и противогрибковой активности вышеуказанных образцов проводились по отношению к штаммам грамположительных бактерий Staphylococcus aureus, Bacillus subtilis, к грамотрицательным штаммам Pseudomonas aeruginosa, Escherichia coli и к дрожжевому грибку Candida albicans методом диффузии в агар (лунок). Препараты сравнения – гентамицин (и бензилпенициллина натриевая соль) для бактерий и нистатин для дрожжевого грибка С. albicans.
Изучение противогрибковой активности вышеуказанных образцов проводились по отношению к дрожжевому грибку Candida albicans и по отношению к условно-патогенному дрожжевому грибку Candida sake. Candida dubliniensis. Candida holmii методом диффузии в агар (лунок). Препарат сравнения – нистатин.
Результаты исследования и их обсуждение
Изучение синтеза тиомочевинных производных анабазина осуществляли следующим образом. Вначале провели синтез исходных изотиоцианатов из соответствующих хлорангидридов п-бромбензойной и 2-фуранкарбоновой кислот при их нагревании с роданистым калием в среде ацетона. Далее образующиеся in situ изотиоцианаты запускали в дальнейшее взаимодействие с алкалоидом анабазином по схеме:
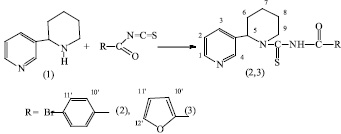
Образующиеся целевые продукты (2,3) (61 и 45 % соответственно), представляют собой хорошо кристаллизующиеся белые кристаллические вещества с умеренной растворимостью в органических растворителях.
В ИК- спектрах синтезированных соединений (2,3) имеется полоса поглощения в области 1545-1535см-1, характерная для C=S группы, полосы поглощения амидной группы C(O)NH проявляются в области 1687-1689 см-1 . При анализе спектров ЯМР 1Н соединений (2,3) наблюдаются характерные сигналы протонов для алкалоидной части (рис. 1). Так, например, в спектре соединения (3) сигналы протонов пиридинового кольца анабазина прописываются в области слабых полей: синглет протона Н4 при 8,68 м.д., дублеты протонов Н1 и Н3 при 8,51 м.д. и 7,51 м.д. и дублет дублетов протона Н2 при 7,44 м.д. Сигналы шести метиленовых протонов Н6, Н7, Н8 проявляются в виде сложного мультиплета в области 1,32-2,00 м.д. Метиленовые протоны Н9 и протон метинной группы Н5 пиперидинового кольца проявляются соответственно при 2,60 м.д. (мультиплет) и 3,03 м.д. (триплет) с КССВ J = 13 Гц. Протоны ароматического фуранового кольца Н10’, Н11’ и Н12’ резонируют соответственно в виде дублета, дублета дублетов и дублета при 7,98 м.д., 6,71 м.д. и 7,88 м.д. Амидный протон N-Н проявляется синглетом при 10,79 м.д. Соотношение интегральных интенсивностей отвечает структуре (3).
С целью подтверждения пространственного строения были выращены кристаллы молекулы N-(анабазино-1-карбонотиоил)фуран-2-карбоксамида (3) и проведено его рентгеноструктурное исследование [1]. Общий вид молекулы 2.39 приведен на рисунке.
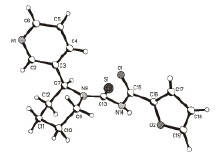
Кристаллическая структура N-(анабазино-1-карбонотиоил)фуран-2-карбоксамида (3)
В ряду соединений, в том числе и природных, таких как витамин В1, пенициллин, содержащих тиазольное и тиазолиновые фрагменты, найдены средства с высокой антибактериальной активностью, а также гербициды, пестициды и стимуляторы роста растений [7, 8].
В работе [4] описывается метод получения тиазолиновых гетероциклических производных из соответствующих аллилсодержащих тиомочевин под действием различных реагентов – растворов галогеноводородов и галогенов. Нами установлено, что синтезированное N-аллилтиокарбамидное производное алкалоида анабазина (4) при нагревании на кипящей водяной бане в запаянной стеклянной ампуле, в растворе концентрированной соляной кислоты может претерпевать внутримолекулярную гетероциклизацию по схеме:
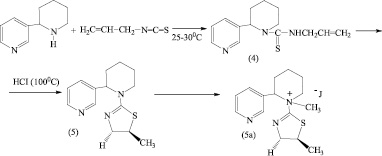
Установлено, что в результате проведенного кислотного взаимодействия образуется с хорошим выходом (50 %) производное анабазина с серосодержащим пятичленным гетероциклом – 2- N-анабазино-5-метил-1,3-тиазолин (5), растворимое во многих органических растворителях. Для получения водорастворимой формы получили его йодметилат (5а).
Механизм данной реакции на первой стадии включает в себя присоединение галогеноводорода по двойной связи аллильного фрагмента тиомочевины по правилу Марковникова. Затем происходит нуклеофильная атака атома серы (в тиольной форме тиомочевины) вторичного углеродного атома С-X с частичным положительным зарядом с последующей внутримолекулярной циклизацией в 1,3-тиазолиновое производное:
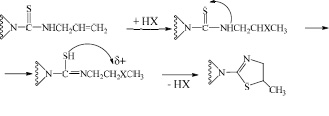
В спектре ЯМР1Н-соединения (5) сигнал интегральной интенсивностью одного протона, проявляющийся в виде уширенного дублета в области 5,22 м.д., нами отнесен к экваториальному протону Н-9, который в других исследуемых нами ранее производных анабазина не проявлялся в такой нехарактерной для него слабопольной части спектра. Метиновый протон пиперидинового кольца проявляется в виде триплета, каждый пик которого дополнительно расщеплен дублетами с расстоянием около 3,3 Гц, свидетельствующего о влиянии на него вращения пиридинового и тиазолинового колец относительно пиперидинового.
Интересным также оказалось также изучение реакции взаимодействия молекулы анабазина с метакрилоилизотиоцианатом, приводящее к внутримолекулярной гетероциклизации промежуточного продукта (6) в 5-метил-2-( N-анабазинил)-5,6-дигидро-1,3-тиазин-4-она (7).
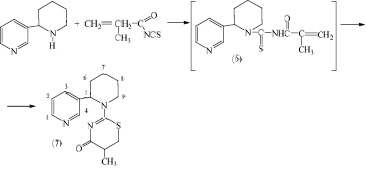
Реакция проходит в довольно мягких условиях при температуре 25-30 °С в среде ацетона. Выход и чистота полученного продукта (7) варьировались в зависимости от скорости и порядка прибавления исходных реагентов. При этом, наиболее высокий выход целевого продукта (7) (41 %) был получен при медленном прикапывании свежеприготовленного ацетонового раствора метакрилоилизотиоцианата к интенсивно перемешиваемому раствору анабазина.
Протекание процесса внутримолекуляной гетероциклизации (6) с образованием 5-метил-2-(N-анабазинил)-5,6-дигидро-1,3-тиазин-4-она (7) в ходе данной реакции, по всей видимости, объясняется тем, что анабазин, находящийся в реакционном растворе в избытке, является довольно сильным основанием и способствует заметному увеличению скорости внутримолекулярной гетероциклизации с образованием (7). Соседство в α-положении у пиперидинового цикла объемного электрононасыщенного пиридинового цикла, вращение вокруг С-С-связи, возможно также оказывает свое влияние на пространственную доступность реакционного центра.
Образование циклического 5-метил-2-(N-анабазинил)-5,6-дигидро-1,3-тиазин-4-она (7) однозначно было доказано отсутствием в спектре ЯМР1Н метиленовых протонов =СН2, проявляющихся для аналогичных метакриловых производных двумя дублетами в области 5,70 и 6,00 м.д., а также синглета амидного N-H протона, участвующего в необходимой при циклизации тион-тиольной перегруппировке. Кроме того, в спектрах ЯМР 1Н соединения (7), происходит расщепление метильных протонов СН3 на дублет, свидетельствующее об их взаимодействии с метиновым СН-протоном тиазинового кольца, появляются сигналы метинового и метиленовых протонов в виде мультиплета и двух дублет дублетов, также свидетельствующих в пользу образования соединений (7) по вышеописанной схеме циклизации.
Физико-химические константы и данные элементного анализа соединений (2-7) представлены в таблице.
Физико-химические константы и данные элементного анализа соединений (2-7)
|
№ соед. |
Выход, % |
Т.пл.°С |
Найдено, % |
Брутто-формула |
|||
|
С |
N |
С |
N |
||||
|
2 |
61 |
82-85 |
53,71 |
10,68 |
С18Н18BrN3OS |
53,47 |
10,39 |
|
3 |
45 |
173-174 |
61,12 |
13,57 |
С16Н17N3OS |
60,93 |
13,32 |
|
4 |
92 |
Масло |
- |
- |
С14Н19N3S |
64,33 |
16,08 |
|
5а |
50 |
100-101 |
64,77 |
16,44 |
С14Н19N3S |
64,33 |
16,08 |
|
7 |
41 |
121-123 |
62,53 |
14,88 |
С15Н19N3OS |
62,25 |
14,52 |
Синтезированные соединения прошли скрининговые испытания на антимикробную активность в отношении бактериальных и грибковых культур в соответствии с методическими указаниями по определению чувствительности микроорганизмов к антибактериальным препаратам [2].Исследование антимикробной активности были проведены на следующих соединениях: 4-бром-N-(анабазино-1-карбонотиоил)бензамид (2), N-(анабазино-1-карбонотиоил)фуран-2-карбоксамид (3), 2-N-анабазино-5-метил-1,3-тиазолин (5), йодметилат 2-N-анабазино-5-метил-1,3-тиазолина (5а), йодметилат 2-(N-анабазино)-5-метил-5,6-дигидро-1,3-тиазин-4-она (7).
Антимикробная активность каждого образца оценивалась по диаметру зон задержки роста тест-штаммов (мм). Диаметр зон задержки роста меньше 10 мм и сплошной рост в чашке оценивали как отсутствие антибактериальной активности, 10-15 мм – слабая активность, 15-20 мм – умеренно-выраженная активность, свыше 20 мм – выраженная. Каждый образец испытывался в трех параллельных опытах.
В результате проведенного биоскрининга на антимикробную активность установлено, что почти все исследованные соединения в условиях in vitro проявляют либо умеренно-выраженную, либо выраженную антибактериальную и противогрибковую активность. Активность соединений оценивается ниже препарата сравнения – гентамицина (и нистатина для грибов), но выше широко известного антибиотика – бензилпенициллина натриевой соли, различаясь в широте действия относительно некоторых грамположительных (Staphylococcus aureus, Bacillus subtilis) и грамотрицательных штаммов (Pseudomonas aeruginosa, Escherichia coli).
Выводы
Изучены реакции взаимодействия алкалоида анабазина с изотиоцианатами различной структуры. Показано, что получаемые N-тиокарбамидные производные анабазина в зависимости от структуры получаемых субстратов и условий реакции могут подвергаться внутримолекулярной гетероциклизации. По результатам проведенных биоиспытаний на антимикробную активность новых серосодержащих производных анабазина установлено, что данные соединения могут быть рекомендованы для дальнейших углубленных исследований с целью изучения возможностей внедрениях их в медицинскую практику.



