Рост тяжелого травматизма в последние годы привел к увеличению числа пострадавших с повреждениями тазобедренного сустава [6], наиболее частыми из которых являются переломы вертлужной впадины [4], составляющие по разным источникам у взрослого населения 3-8 % от переломов костей таза [9]. Они происходят главным образом в результате высокоскоростной травмы при дорожно-транспортном происшествии либо падении с высоты и чаще встречаются у молодых людей и трудоспособной части населения [4], что определяет социально-экономическую значимость данной проблемы.
Трудность лечения больных с последствиями таких переломов определяется сопутствующей травматизацией органов малого таза, повреждением нервных стволов и сплетений [3]. Неврологический дефицит в виде частичного или полного пареза седалищного нерва наблюдается у 7,9-24,6 % больных [1, 4, 8]. Седалищные невропатии, связанные с травмой таза, в том числе переломом вертлужной впадины, распознаются, как правило, в поздние сроки лечения [3], что диктует необходимость ранней диагностики характера и степени тяжести повреждения седалищного нерва с целью выбора адекватных методов реабилитационной терапии.
В ранее проведенных исследованиях изучено изменение седалищного нерва при сочетанном переломе седалищной кости и шейки бедренной кости [2]. Сведения об этиопатогенезе седалищных невропатий при переломах вертлужной впадины, необходимые для решения лечебно-тактических вопросов, в доступной литературе не найдены.
Цель исследования – выявить патоморфологические изменения седалищного нерва при лечении перелома вертлужной впадины методом чрескостного остеосинтеза в эксперименте.
Материалы и методы исследования
Эксперимент проведен на 13 взрослых беспородных собаках обоего пола с массой тела 11-20 кг. Собаки содержались в стандартных условиях вивария, оперативные вмешательства и эвтаназию осуществляли в соответствии требованиями Министерства здравоохранения Российской Федерации к работе экспериментально-биологических клиник, а также «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей». Все манипуляции, проводимые на животных, были рассмотрены и одобрены этическим комитетом ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова. В условиях операционной, под внутривенным комбинированным наркозом животным выполняли поперечную остеотомию вертлужной впадины на уровне ее геометрического центра с последующей репозицией отломков и поддержанием их стабильной фиксации аппаратом на протяжении всего периода лечения. Животных выводили из эксперимента через 14 и 42 суток путем внутривенного введения 5 % раствора тиопентала натрия в летальной дозе.
После эвтаназии производили резецирование седалищных нервов оперированных конечностей на уровне проксимальной части бедренной кости. Материал фиксировали в смеси 2 % растворов глутарового и параформальдегидов на фосфатном буфере (рН 7,4) с добавлением 0,1 % пикриновой кислоты, постфиксировали в 1 % растворе тетраоксида осмия с 1,5 % красной кровяной солью, дегидратировали в этаноле возрастающей концентрации и заливали в аралдит. Поперечные и продольные полутонкие срезы получали на ультратоме «Nova» (LKB, Швеция), окрашивали метиленовым синим и основным фуксином. В оцифрованных на аппаратно-программном комплексе «ДиаМорф» (ЗАО ДиаМорф, Россия) изображениях полутонких срезов (не менее 30 полей зрения от каждого нерва, содержащих не менее 500 миелиновых нервных волокон) определяли долю ( %) деструктивно измененных миелиновых нервных волокон. Контроль – седалищные нервы 4 интактных собак.
Результаты исследования и их обсуждение
У всех животных в течение всего эксперимента седалищный нерв на стороне повреждения сохранял анатомическую непрерывность.
Через 14 и 42 суток лечения в седалищных нервах наблюдались аналогичные патоморфологические изменения.
У 3 собак в изученные сроки лечения перелома (14 и 42 суток) доля деструктивно измененных волокон с признаками демиелинизации, аксональной и валлеровской дегенерации не превышала 5 % (в интактном седалищном нерве этот показатель составил 2,51±0,1 %). У этих животных седалищный нерв отличался от аналогичного интактного нерва незначительно. Соединительнотканные оболочки нерва сохраняли целостность. В эпиневрии повышалось количество фибробластов, фиброцитов и тучных клеток. Вблизи эпиневральных сосудов располагались периваскулярные клетки, единичные макрофаги и плазматические клетки. Эпиневральные сосуды имели расширенные просветы, ядра эндотелиальных клеток кубической или округлой формы выбухали в просвет. Средняя оболочка была утолщена. Через 42 суток лечения наблюдалась незначительная гиперваскуляризация эпиневрия. Периневрий сохранял целостность и типичное для неповрежденного нерва строение. Между слоями периневральных клеток формировались многочисленные поперечные мостики (рис. 1А), представленные цитоплазматическими клеточными выростами. Признаки субпериневральных отеков не обнаруживались. Эндоневральные кровеносные сосуды сохраняли нормальное строение, но имели, в отличие от интактного нерва, расширенные просветы. Большинство (95 % и более) миелиновых нервных волокон имели нормальную структуру (рис. 1Б).
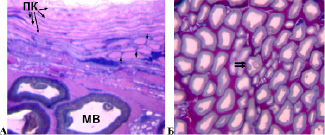
Рис. 1. А – периневрий седалищного нерва собаки. Срок опыта 14 суток. ПК – слои периневральных клеток, стрелки – «мостики» между слоями периневральных клеток, представленные цитоплазматическими клеточными выростами. МВ – миелиновое нервное волокно. Б – нервные волокна седалищного нерва собаки. Срок опыта 42 суток. Двойная стрелка – МВ с признаками валлеровской дегенерации. Поперечный полутонкий срез. Окраска метиленовым синим и основным фуксином. А – об. 100, ок. 12,5х; Б – об. 40, ок. 12,5х
У 7 собак в течение эксперимента доля деструктивно измененных волокон с признаками демиелинизации, аксональной и валлеровской дегенерации составила в седалищном нерве 5-20 %. Соединительнотканные оболочки нерва сохраняли целостность. Эпиневрий выглядел отечным. Отмечалось повышение количества периваскулярных клеток, тучных клеток, которые в интактных седалищных нервах единичны. Появлялись отсутствующие в норме плазмоциты и лимфоциты. Визуально отмечалось повышение толщины стенок эпиневральных кровеносных сосудов относительно аналогичных микрососудов интактных нервов. Наружные оболочки большинства артерий и артериол были склерозированы. Часть мелких сосудов имела некротические изменения клеточных элементов стенки. Периневрий сохранял тонколамеллярное строение, часть периневральных клеток имела вакуолизированную цитоплазму. В отдельных пучках наблюдались периневральные (рис. 2 А) и субпериневральные отеки. Просветы эндоневральных микрососудов, в отличие от интактных нервов, были расширены. В эндоневрии отмечалось повышение относительно контроля количества фибробластов, фиброцитов, тучных клеток и нейролеммоцитов. Обнаруживались отсутствующие в контроле макрофаги и плазматические клетки. И в продольных, и в поперечных срезах были видны деструктивно измененные волокна (рис. 2 Б), однако большинство нервных проводников имели нормальную структуру.
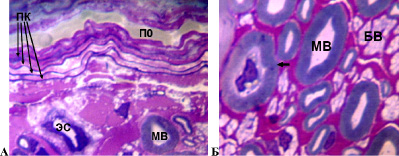
Рис. 2. Срок опыта 14 суток. А – периневрий, Б – нервные волокна седалищного нерва собаки. ПК – слои периневральных клеток. ПО – периневральный отек; ЭС – эндоневральный сосуд; МВ – миелиновое нервное волокно; БВ – безмиелиновое нервное волокно; стрелка – МВ с признаками аксональной дегенерации. Поперечный полутонкий срез. Окраска метиленовым синим и основным фуксином. Об. 100, ок. 12,5х
У 3 собак доля деструктивно измененных волокон в седалищном нерве составила более 20 %. При этом соединительнотканные оболочки нерва сохраняли целостность. Эпиневрий был отечным с признаками реактивного воспаления. В нерве обнаруживались скопления фибробластов, фиброцитов, тучных клеток (единичных в контроле), плазмоцитов и клеток лейкоцитарного ряда (в основном лимфоцитов). Визуально отмечалось повышение толщины всех слоев сосудистых стенок артерий и артериол эпиневрия в сравнении с контролем. Часть мелких сосудов имела некротические изменения клеточных элементов стенки. Периневрий утрачивал тонколамеллярное строение, большинство периневральных клеток имели вакуолизированную цитоплазму (рис. 3 А), обнаруживались обширные периневральные и субпериневральные отеки. Эндоневральные сосуды имели расширенные просветы, часть из них – признаки некротических изменений клеточных элементов стенки (рис. 3 Б). В поперечных и продольных срезах среди миелиновых волокон нормальной структуры были видны многочисленные проводники с признаками деструктивных изменений, продукты их распада, тучные клетки, нейролеммоциты, макрофаги и клетки воспалительного ряда. У одной собаки миелиновые волокна нормальной структуры были единичны (рис. 4).
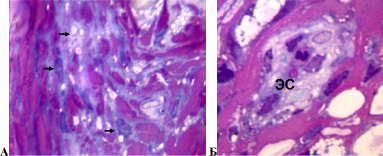
Рис. 3. Срок опыта 14 суток. А – периневрий, Б – эндоневральный микрососуд седалищного нерва собаки. Стрелками показаны периневральные клетки с вакуолизированной цитоплазмой. ЭС – эндоневральный сосуд с некротически измененными клеточными элементами всех слоев сосудистой стенки. Поперечный полутонкий срез. Окраска метиленовым синим и основным фуксином. Об. 100, ок. 12,5х
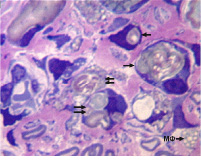
Рис. 4. Срок опыта 14 суток. Седалищный нерв собаки. Валлеровская дегенерация (стрелки) и продукты распада миелиновых волокон (двойные стрелки). МФ – макрофаги, содержащие крупные вакуоли. Поперечный полутонкий срез. Окраска метиленовым синим и основным фуксином. Об. 100, ок. 12,5х
Таким образом, у 23,1 % собак через 14 и 42 суток лечения перелома наблюдались умеренные реактивные изменения седалищного нерва, выражающиеся в повышении клеточности эпиневрия и его гиперваскуляризации к концу эксперимента, в изменении клеточных компонентов периневрия, аналогичных описанным при дистракционном остеосинтезе [7] и оскольчатом переломе голени собак [5]. Доля деструктивно измененных миелинизированных волокон не превышала 5 %.
У большинства исследованных животных даже при отсутствии механического повреждения оболочек седалищного нерва обнаруживались признаки нарушения эпиневральной и эндоневральной васкуляризации, признаки реактивного воспаления эпиневрия, периневрит и значительная травматизация нервных проводников. В 53,8 % случаев деструкции были подвержены до 20 % нервных проводников. По данным D.Quan, S.J.Bird (1999) при таком количестве травмированных аксонов восстановление нерва обеспечивается за счет терминального спраутинга интактных аксонов в срок от 2 до 6 месяцев. У 23,1 % животных аксональная и валлеровская дегенерация охватывала более 20 % волокон. При такой потере волокон коллатеральный спраутинг интактных аксонов и регенерация аксонов от места травмы становятся равнозначными механизмами восстановления нерва, на которое требуется от 2-6 до 18 месяцев [10].
Заключение. При переломе вертлужной впадины происходит травматизация седалищного нерва по типу нейропраксии и аксонотмезиса. При этом повреждаются миелиновые оболочки и аксоны нервных волокон с последующей валлеровской дегенерацией без поражения оболочек нерва, что может быть обусловлено его альтерацией в момент костной травмы и последующим сдавлением в травмированной области гематомами и формирующимися рубцово-спаечными образованиями. Несмотря на созданные благоприятные биомеханические условия для сращения отломков вертлужной впадины, в большинстве случаев, на морфофункциональное восстановление седалищного нерва, требуется не менее 6-18 месяцев.
Полученные экспериментальные данные послужат теоретическим обоснованием для разработки комплекса лечебных мероприятий при посттравматических невропатиях седалищного нерва, осложняющих переломы вертлужной впадины.



