При исследовании метаболитов оксида азота (NO) в крови после стандартной травмы нижней челюсти у крыс с нормально протекающими процессами ремоделирования альвеолярной кости и нарушенными вследствие введения дексаметазона мы обнаружили значительное отличие в метаболизме NO между группами [4]. На следующем этапе работы мы провели сопоставление морфологических процессов в альвеолярной кости после ее травматического повреждения (сквозной дырчатый дефект нижней челюсти) с метаболическими показателями крови, среди них с метаболитами NO, в различные стадии посттравматической регенерации и установили определенную взаимосвязь между ними [3]. В частности, чувствительным показателем перестройки и созревания костного регенерата оказался нитрит-анион. Это стало основой предположения о возможности использования метаболитов NO в качестве прогностического критерия течения посттравматического периода. Для его подтверждения мы решили исследовать метаболиты NO при аналогичном травматическом повреждении нижней челюсти у крыс с остеопорозом.
Цель исследования. Сопоставить динамику морфологических процессов посттравматической регенерации альвеолярной кости с содержанием метаболитов NO в крови у крыс с остеопорозом, вызванным дексаметазоном.
Материалы и методы исследования
Эксперимент проведен на 46 половозрелых крысах-самцах линии WAG. Животные были разделены на 3 группы: 1 группа – интактные (n=8); 2 группа – остеопороз (n=12); 3 группа (основная) – остеопороз+травма нижней челюсти (n=26). Остеопороз в группах 2 и 3 моделировали введением дексаметазона из расчета 1,675 мг/кг 1 раз в сутки внутримышечно в течение 2 недель. Животным 3 группы наносили травматическое повреждение нижней челюсти в виде перфорационного (сквозного дырчатого) дефекта диаметром 2 мм [4]. Оперативное вмешательство осуществляли под общим наркозом (аминазин 10 мг/кг, кетамин 50мг/кг) в условиях асептики и антисептики. Эксперименты на животных проведены в соответствии с требованиями Европейской конвенции о защите позвоночных животных, использующихся в экспериментальных и других научных целях, законом Украины «О защите животных от жестокого отношения». Протокол экспериментов на животных и соответствие проведенных научных исследований современным требованиям биоэтики утверждены Комитетом по вопросам биоэтики Харьковского национального медицинского университета. Гистологические исследования альвеолярной кости с участком травматического дефекта были выполнены в соответствии с общепринятыми методами, руководствуясь рекомендациями Д.С. Саркисова, Ю.Л. Перова [8]. Морфометрию проводили по Г.Г. Автандилову [1]. Использовали окраску срезов гематоксилином и эозином, пикросириусом красным, что позволило определить степень зрелости коллагеновых волокон, а также исследование окрашенных срезов в поляризованном свете для выявления ориентационной упорядоченности коллагеновых структур и начала образования грубоволокнистых костных трабекул [9,10]. Во всех группах определяли содержание суммарных метаболитов NO и нитрит-аниона в крови [7]. У животных 3 группы эти показатели изучали в динамике на 7, 14, 28 и 45 сутки. Использованные измерения и параметры были приведены в соответствии с международной системой единиц, а полученные цифровые данные обрабатывали общепринятыми методами вариационной статистики на персональном компьютере с использованием прикладных программ «Stadiа-6».
Результаты исследования и их обсуждение
Прежде всего следует отметить, что еще до травмы под влиянием двухнедельного введения дексаметазона (2 группа) в альвеолярной кости происходят нарушения остеопоретического характера всех структурных компонентов челюсти, с наиболее выраженными проявлениями в компактной (рис. 1) и губчатой (рис. 2) костях. Исследование содержания общих метаболитов NO и нитрит-аниона у этих крыс показало, что под влиянием дексаметазона концентрация первых снижается, вторых – увеличивается по сравнению с интактными животными (рис 3 а,б).
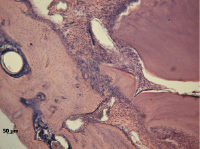
Рис. 1. Компактная кость с резорбционными полостями. Нарушение организации периодонта. Гематоксилин и эозин. Ув. 100
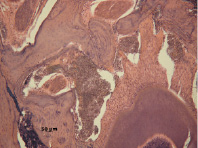
Рис. 2. Участок губчатой кости. Стенка альвеолы нарушена. Ткань периодонта в виде «языков» располагается между фрагментами губчатой кости. Очаги клеточного детрита. Гематоксилин и эозин. Ув. 100
а 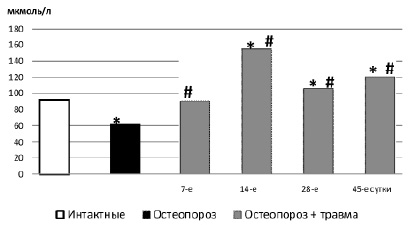
б 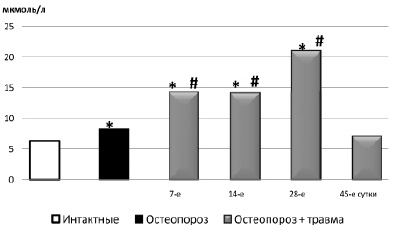
Рис. 3. Содержание общих метаболитов оксида азота (а) и нитрит-аниона (б) в сыворотке крови крыс с остеопорозом после травмы альвеолярной кости: * – достоверно относительно 1 группы (интактные); # – достоверно относительно 2 группы (остеопороз)
На фоне остеопоретического повреждения альвеолярной кости происходят следующие нарушения процессов остеорепарации.
Через 7 дней после травмы отсутствует даже начальное формирование костных трабекул (рис. 4). Превалирует грануляционная ткань, в то время как при обычном течении процесса площадь фиброретикулярной ткани более чем в 2 раза превышает площадь грануляционной [6]. Концентрация общих метаболитов NO увеличивается после травмы влиянием травмы в сравнении с обнаруженной до операции, но не выходит за пределы уровня интактных крыс (рис. 3а). Содержание нитрит-аниона увеличивается в 1,7 раза в сравнении с таковым до операции и превышает норму в 2,2 раза (рис. 3б).
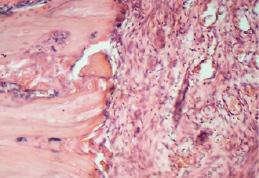
Рис. 4. Участок дефекта. Молодая грануляционная ткань. Низкая плотность клеток. Синусоиды. В материнской кости выраженные деструктивные изменения. 7 сутки. Гематоксилин и эозин. Ув. 100
О замедлении темпов репарации на 14 сутки свидетельствует наличие в регенератах кровяного сгустка, присутствие крупных территорий грануляционной ткани, превалирование тонких коллагеновых волокон при исследовании в поляризованном свете. В материнской кости, окружающей дефект, по-прежнему определялись значительные деструктивные изменения, аналогичные отмеченным на 7 сутки. Отсутствие гистологической динамики между 7 и 14 сутками после повреждения соответствует стабильному повышению нитрит-аниона в крови в эти же сроки. Концентрация общих метаболитов NO достигает максимума.
Через 28 суток отставание процессов посттравматической регенерации альвеолярной кости проявилось в значительном замедлении перестройки грануляционной ткани, очаги которой выявляются даже в этот срок. При обычном течении процесса грануляционная ткань отсутствует уже на 14 сутки [6]. При исследовании препаратов в поляризованном свете также обнаружено замедление процесса коллагенообразования и формирования зрелых пучков коллагеновых волокон. Морфометрические исследования обнаружили замедление нарастания массы коллагеновых волокон в формирующемся регенерате. Ориентационная упорядоченность, формирование коллагеновых волокон и их пучков нарушена.
В материнской кости вблизи дефекта, а также в губчатой кости тела челюсти сохранились отмеченные на предыдущий срок деструктивные изменения. Что касается метаболитов NO, то концентрация нитрит-аниона в крови достигает максимума. Уровень общих метаболитов NO снижается по сравнению с 14 сутками, но остается выше по сравнению с 1 и 2 группой.
Через 45 суток у животных основной группы регенерат узкий, представлен губчатой, а не пластинчатой, как при обычной посттравматической регенерации альвеолярной кости, костной тканью с расширенными межтрабекулярными пространствами, заполненными фиброретикулярной тканью. Исследования в поляризованном свете подтвердили низкую зрелость регенерата и различную зрелость костных трабекул. Содержание общих метаболитов NO по-прежнему превышает как норму, так и показатели 2 группы (остеопороз), содержание нитрит-аниона достоверно не отличается от показателей 1 и 2 группы (рис. 3 а,б).
Таким образом, сопоставление результатов морфологических исследований динамики посттравматической регенерации альвеолярной кости, происходящей на фоне глюкокортикоидного остеопороза, и метаболитов NO в крови показывает, что нарушение процессов остеорепарации находит отражение в изменениях содержания метаболитов NO в крови. Несмотря на отмеченное снижение содержание общих метаболитов NO под влиянием дексаметазона, их концентрации в дальнейшем (после травмы) быстро нарастает. Кроме того, при снижении общих метаболитов NO под влиянием дексаметазона, концентрация нитрит-аниона превышает норму. В динамике заживления концентрация этого метаболита прогрессивно растет, что представляет опасность в связи с образованием токсичного пероксинитрита. Чрезмерное нарастание метаболитов NO расценивается как формирование вторичного иммунодефицитного состояния [2], ведет к угнетению обмена веществ в костной ткани, угнетает рост и дифференцировку остеобластов [5].
Выводы
Развитие глюкокортикоидного остеопороза у крыс характеризуется нарушением процессов ремоделирования альвеолярной кости и сопровождается увеличением концентрации нитрит-аниона и снижением общих метаболитов NO в крови.
Посттравматическая регенерация альвеолярной кости у крыс с глюкокортикоидным остеопорозом сопровождается увеличением общих метаболитов NO и нитрит-аниона в крови.
Авторы выражают сердечную благодарность за консультативную помощь в настоящем исследовании заведующей лабораторией морфологии соединительной ткани ГУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка АМН України» доктору бииологических наук профессору Дедух Нинель Васильевне.



