Во всех учебниках по офтальмологии и литературных источниках, посвященных изучению гемодинамики сетчатки, убедительно рассказывают, но не доказывают, что вода из стекловидного тела проходит через ткань сетчатки и всасывается хориоидеей [3, 9]. Не будем углубляться в подробности возникновения данной гипотезы, но этот парадоксальный факт полностью искажает патогенез многих заболеваний сетчатки.
Морфофункциональное строение хориокапилляров практически ничем не отличается от капилляров цилиарного тела и капилляров клубочкового аппарата почек. Нет ни у кого сомнений, что клубочки почек и цилиарное тело продуцируют жидкость, но почему тогда хориоидея ее всасывает? Современные исследования гемодинамики показывают, что по закону Лапласа для эластических трубок, которыми по сути являются мышечные артерии, находящиеся в эластиновой адвентиции, после сердечного сокращения сосуды микроциркуляторного русла сначала пассивно расширяются поглощая пульсовой объем крови, а затем, вследствие сокращения мышечных волокон сосудистой стенки продавливают объем полученной жидкости в обменные сосуды, выполняя тем самым роль «периферического сердца». Причем этот факт полностью меняет понимание механизмов регуляции кровообращения на микроциркуляторном уровне и предполагает изменение функциональной классификации сердечно-сосудистой системы [4, 5, 6, 7, 8].
В соответствии с вышеизложенным материалом нам представляется необходимым несколько изменить классификацию сердечно-сосудистой системы, предложенную Б.И. Ткаченко, следующим образом (рис. 1):
Исследование процесса обмена веществ между кровью и тканями требует детальных знаний таких факторов, как объем диффузии, градиенты концентрации, и структурные барьеры, ограничивающие свободное распространение жидкости в общем ее потоке. Незнание этих факторов в описании массопереноса довольно часто приводит к ошибкам, порождая такие термины, как «насыщение ткани», «улучшение трофики» и тому подобное [1, 3]. Применение основных физических и математических законов позволяет по-новому взглянуть на эту проблему [2, 4, 5, 10].
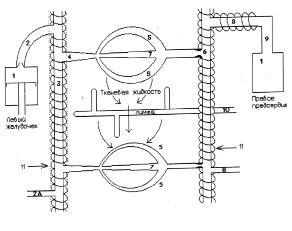
Рис. 1. Функциональная схема кровеносных сосудов: 1 – сердце; 2 – артерии эластического типа; 2А – артерио-артериальный анастомоз; 3 – артерии мышечного типа; 4 – артериолы; 5 – обменные сосуды (капилляры и посткапиллярные венулы); 6 – регуляторы кровотока (венулярные сфинктеры и малые мышечные вены); 7 – шунтирующие сосуды; 8 – аккумулирующие сосуды; 9 – сосуды возврата крови (крупные венозные коллекторы); 10 – лимфатические сосуды; 11 – циркулярные мышечные волокна
Существует два основных механизма массопереноса через сосудистую стенку [4, 6, 8, 11, 14]: 1 – движение веществ с молекулами воды по градиенту гидростатического давления (конвективный перенос); 2 – диффузионного обмена молекул за счет различных концентраций вещества по разные стороны сосудистой стенки.
Диффузия веществ из микрососудов в ткани подчиняется закону Фика, согласно которому, разница концентрации веществ в среде, провоцирует движение этого вещества в направлении области низкой концентрации и пропорциональна градиенту концентрации.
Направление движения воды зависит от двух сил – градиента осмотического и гидравлического давления. В обменных сосудах эти силы чаще всего имеют противоположное действие, осмотическое трансмуральное давление заставляет двигаться молекулы воды внутрь сосуда, а гидравлическое – из сосуда. В работе двадцатилетней давности мы показали и доказали, что в хориокапиллярах трансмуральное гидравлическое давление выше, чем в обменных сосудах сетчатки, поэтому жидкость движется в наружных слоях сетчатки из хориокипилляров в сосуды сетчатки. Пора пересмотреть выражение «наружные слои сетчатки питаются из хориокапилляров, а внутренние из сосудов сетчатки», так как обе сосудистые системы обеспечивают метаболизм палочек и колбочек. За счет диффузии из обеих систем по градиенту концентрации поступает кислород, в обратную сторону движется углекислый газ. Вещества, вступающие в нековалентную связь с молекулами воды, не могут свободно проникать через клеточную мембрану, поэтому они проходят внутрь клетки за счет пиноцитоза.
В 2013 году Нобелевский комитет решил отметить работу ученых, раскрывших тайны внутриклеточного транспорта. Каждая клетка, по сути – «завод» по производству молекул: производится и выбрасывается в кровь инсулин, нейротрансмиттеры передаются от одной клетки к другой… [18].
Клетке, производящей гормоны, нейромедиаторы, цитокины, ферменты и другие молекулы, как крупному оживленному порту, необходима система, обеспечивающая правильную и своевременную доставку молекулярных «грузов». Пузырьки везикул, окруженные защитными мембранами, перевозят молекулы в пределах клетки (от одной органеллы к другой) или выпускают наружу, слившись с клеточной мембраной. Этот процесс имеет жизненно важное значение: если в качестве груза выступает нейротрансмиттер – его доставка необходима для активации нерва, а, например, «выгруженные» в нужном месте гормоны регулируют процесс обмена веществ. Откуда же эти крошечные пузырьки, везикулы, знают, где и когда сбросить свою ношу [12]?
Еще в 1970-х годах Рэнди Шэкман, очарованный четкой организацией внутриклеточной транспортной системы, взялся за изучение её генетической основы. В качестве модельных организмов он выбрал дрожжи и выделил среди них те клетки, в которых был нарушен механизм везикулярного транспорта. В результате генетических мутаций в клетке образовывалось подобие дорожных пробок: везикулы скапливались в одной её части [15]. Шекман выделил три класса генов, регулирующих «дорожное движение» внутри клетки, сформировав новое научное видение процессов и механизмов, определяющих организацию везикулярного транспорта [14].
Джеймс Ротман, также заинтересовавшийся природой внутриклеточной транспортной системы, обнаружил белковый комплекс, который позволяет везикулам присоединяться к клеточной мембране и сливаться с ней. В процессе слияния белковые молекулы на поверхности везикулы и мембраны стыкуются друг с другом, как две половинки замка-молнии. Каждый из множества таких «парковочных» белков может связываться с парным ему только в определенной комбинации. Благодаря такой избирательности гарантируется, что «груз» будет доставлен точно по назначению [12, 17].
Выяснилось, что ряд генов, кодирующих необходимые для везикулярного транспорта белки и обнаруженных Шэкманом в дрожжевых клетках, имеет своих «потомков» и в клетках млекопитающих, исследованиями которых занимался Ротман. Ученые выявили эволюционную взаимосвязь между везикулярными транспортными системами различных организмов и обозначили важнейшие компоненты этих систем. [13].
Томас Зюдхоф занимался изучением вопроса «общения» нервных клеток мозга между собой. Нейротрансмиттеры (молекулы, служащие для передачи сигнала) доставляются к месту назначения везикулами, сливающимися с мембранами нервных клеток – механизм этого процесса описали Шэкман и Ротман. Но высвобождается этот «груз» не сразу, а только в тот момент, когда нервной клетке необходимо подать сигнал своей соседке. Как везикула «узнает», что момент настал? Было известно, что в этом процессе каким-то образом участвуют ионы кальция, и Зюдхоф стал искать в нервных клетках белки, чувствительные к кальцию. Он выявил механизм, отвечающий за пунктуальность везикул в нервных клетках и позволяющий «пузырькам» высвобождать своё содержимое по команде. [16].
Несомненно, процессы обмена, потребления и секреции сложных молекул генетически детерминированы и выстраивались природой на протяжении миллионов лет. Однако первичный механизм возникновения пиноцитозных пузырьков, также является результатом действия гидравлических сил. Свободная молекула воды легко проходит через поры клеточной мембраны, но связанная с другими молекулами вода застревает в этих порах, создавая плоскостное сопротивление общему потоку воды. Клеточная мембрана механически продавливается и образуется везикула. В дифференцированных клетках эти везикулы обычно вливаются в клеточные органеллы, таким образом, в частности, глюкоза попадает в митохондрии и т.д. А уже за применение и распределение вещества отвечают регуляторные белки отвечающие за реализацию функциональной принадлежность клетки в которой происходит транспорт веществ . В эндотелиоцитах капилляров они проходят через клетку, выбрасывая свое содержимое в интерстициальное пространство. Когда в хориокапиллярах описывают фенестрированный эндотелий, на самом деле это гистологическая ошибка. Фенестрированная цитоплазматическая мембрана не может существовать, это просто скопление застывших везикул вдоль наружной клеточной мембраны, возникающее в результате падения трансмурального гидравлического давления в хориокапиллярах из-за гибели организма или энуклеации глаза.
Однонаправленный поток воды в наружных слоях сетчатки необходим для секреторной деятельности палочек и колбочек. Для поддержания нормальной зрительной функции эти клетки должны вырабатывать и выбрасывать в синаптическое пространство не менее 50 везикул с водным раствором нейропептида за одну секунду (средняя величина критической частоты слияния мельканий – КЧСМ). Можно себе представить какой объем воды необходим для осуществления этого действия.
Такому мощному потоку воды через палочки и колбочки помогает анатомическое строение самой сетчатки. Наибольшее сопротивление движению воды составляют пограничные мембраны эпителиальных слоев. Наружная пограничная мембрана сетчатки, в отличие от внутренней, имеет окна, в которые вставлены отростки сенсорного нейроэпителия. Поскольку сосуды сетчатки только впитывают в себя свободные молекулы воды (для этого не нужны везикулы), они создают определенный вакуум в ткани сетчатки. За счет окон наружной пограничной мембраны она присасывается к пигметному эпителию сетчатки, втягивая в себя воду с секретом пигментного эпителия, необходимого для жизнедеятельности палочек и колбочек. Чем больше света, тем глубже погружаются наружные сегменты нейроэпителия в клетки пигментного эпителия сетчатки. Нами подробно описан механизм миогенной ауторегуляции кровотока на микроциркуляторном уровне, отвечающий за постоянство трасмурального гидравлического давления в обменных сосудах сетчатки. Малейший срыв ауторегуляции кровотока как в хориоидее, так и в бассейне центральной артерии сетчатки, сопровождается выраженными функциональными нарушениями со стороны сетчатки.
Описанные выше механизмы о массопереносе в сосудах сетчатки и хориоидее можно изобразить следующей схемой (рис. 2).
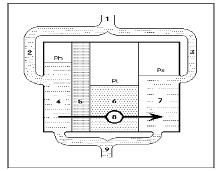
Рис. 2. Схема движения интерстициальной жидкости в наружных слоях сетчатки: 1 – a. Ophtalmica; 2 – артериолы хориоидеи; 3 – артериолы сетчатки; 4 – капилляры хориоидеи; 5 – пигментный эпителий; 6 – ткань сетчатки; 7 – капилляры сетчатки; 8 – ток интерстициальной жидкости; 9 – венозный коллектор; Ph – трансмуральное давление крови в капиллярах хориоидеи; Pt – тканевое давление; Ps – трансмуральное давление крови в капиллярах сетчатки
Учитывая, что обе сосудистые системы глаза находятся в единой гидравлической системе, ограниченной фиброзной капсулой глазного яблока, жидкость по градиенту давления будет выходить из хориокапилляров и всасываться капиллярами сетчатки, что подтверждается результатами флюоресцентной ангиографии. Только при тромбозе венозных сосудов и воспалительных процессах сетчатки наблюдается экстравазация флюоресцеина из сосудов сетчатки. Необходимо отметить также, что отсутствие выхода флюоресцеина из ретинальных сосудов не связано с наличием гематоофтальмического барьера, краситель не выходит только лишь потому, что трансмуральное гидравлическое давление в капиллярах сетчатки ниже осмотического давления плазмы крови. Вследствие этого наблюдается однонаправленное движение жидкости из ткани в обменные сосуды сетчатки.
Однонаправленный ток жидкости наблюдается и в других тканях глазного яблока. Так, внутриглазная жидкость выходит из капилляров цилиарного тела, проходит из задней камеры глаза в переднюю, через эндотелий проникает в ткань роговицы, двигается по направлению к лимбу и всасывается сосудами петлистой сети, которая также при флюоресцентной ангиографии не дает картины экстравазации. Не наблюдается в норме выхода флюоресцеина и из сосудов радужки.
Таким образом, применение фундаментальных законов физики и математики позволяет с новых позиций подойти к пониманию регуляции и функционирования системы кровообращения на уровне микроциркуляторного русла. Направленное движение тканевой жидкости наблюдается не только в полости глазного яблока, но и в других органах и системах организма – почках, печени и т.д. Признание факта однонаправленности движения жидкости в организме, подчиняющееся действию физических законов позволяет существенно изменить взгляд на патогенез многих сосудистых заболеваний.
Применение данной гипотезы в клинической практике (новые подходы в лечении воспалительных заболеваний глаза, пролиферативной витреоретинопатии различного генеза, макулярных дегенераций) доказало ее правильность.
В последние годы почти любое заболевание сетчатки пытаются связать с «нарушением питания и гипоксией сетчатки». Этот парадокс не поддается объяснению, поскольку задний отрезок глаза является самой васкуляризированной частью всего организма. Пора прекратить средневековый взгляд на гемодинамику глаза и рассматривать патогенез заболеваний сетчатки с позиции современной биохимии, биофизики и биомеханики с использованием математических моделей.



