Несмотря на развитие реконструктивно-восстановительной хирургии и восстановительной медицины, результаты лечения травм нервов в клинике у многих пациентов далеки от удовлетворительных. Одно из объяснений – сложность молекулярно-биологических механизмов, лежащих в основе взаимодействия нейронов, глиальных и иммунных клеток, обеспечивающих регенерацию повреждённых нервных волокон.
Многочисленные экспериментальные исследования и обзоры посвящены роли клеток воспалительного ряда в аксональной регенерации и генезе нейропатической боли: нейтрофилы мигрируют в зону повреждения нерва и выделяют цитокины, рекрутирующие гематогенные макрофаги, но после первых суток подвергаются апоптозу; макрофаги помимо участия в валлеровской дегенерации совместно с мастоцитами регулируют реваскуляризацию и ремоделирование межклеточного матрикса, а также дополнительное рекрутирование лейкоцитов, в том числе лимфоцитов [3, 5]. T-лимфоциты, инфильтрирующие повреждённый нерв через 3 дня после повреждения и достигающие пика концентрации в период от 14 до 28 дней, выделяют про- и противовоспалительные цитокины, регулируя деятельность макрофагов и промотируя аксональную регенерацию [4]. Получен положительный эффект параневральной трансфузии культивированных лимфоцитов на скорость проведения по лицевому нерву, регенерирующему после перерезки и шва [10]. Сведения об изменениях лимфоцитов при повреждениях и регенерации нервов получены в опытах на грызунах. Неизвестна их роль в нейрорегенерации у других видов животных. Данные об изменениях лимфоцитов периферической крови при повреждении и регенерации нервов в доступной литературе также отсутствуют.
Цель работы – выявить количественные и качественные изменения лимфоцитов периферической крови при повреждении и регенерации седалищного нерва у собак.
Материалы и методы исследования
Исследование проведено на 18 взрослых беспородных собаках, оперированных под внутривенным барбитуровым наркозом в асептических условиях операционной. Из внепроекционного доступа обнажали седалищный нерв на уровне средней трети бедра. Затем выполняли его полную перерезку ножницами Millesi и эпи-периневральный шов с применением микрохирургической техники. Использовали инструментарий фирмы Aesculap AG (Германия), нити фирмы Ethicon LTD (UK), марка 8/0 Ethilon, оптическое увеличение 8-16х операционного микроскопа Zeiss OPMI-6 фирмы Opton (Германия). Животные содержались в виварии, оперативные вмешательства и эвтаназию осуществляли в соответствии с требованиями Министерства здравоохранения Российской Федерации к работе экспериментально-биологических клиник, а также «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей». Все манипуляции, проводимые на животных, были рассмотрены и одобрены этическим комитетом.
В период от 3 до 63 дней после операции проводили еженедельное исследование морфологии периферической крови. Кровь забирали из подкожной латеральной вены голени. Количество лейкоцитов в периферической крови подсчитывали в камере Горяева, лейкоцитарную формулу – в мазке крови, окрашенном по Романовскому-Гимза, который изготавливали из дозированного объёма крови в виде монослоя. По стандартной методике определяли абсолютное и относительное содержание лимфоцитов в периферической крови. С целью оценки содержания реактивных лимфоцитов применили алгоритм компьютерного анализа цифровых изображений лимфоцитов, описанный нами ранее [2], однако в данном исследовании оценивали процентное содержание реактивных лимфоцитов только двух типов: R1 и R2. К типу R1 относили малые и средние лимфоциты до 10 мкм диаметром со сниженным ядерно-цитоплазматическим отношением (ободок цитоплазмы > 2 мкм), цитоплазма тёмно-базофильная с мелкими гранулами или вакуолями, ядро как правило эксцентричное (рис. 1) с глубокими вдавлениями или дольчатое. К реактивным светлым большим лимфоцитам типа R2 относили клетки более 12 мкм диаметром с обильной светлой цитоплазмой и базофилией в основном по контуру клетки; многие из этих клеток имели полигонально-отросчатую форму, обтекающую эритроциты (рис. 2).
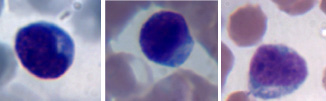
Рис. 1. Реактивные лимфоциты первого типа в мазке периферической крови собак. Окраска по Романовскому-Гимзе. Увеличение 1250х
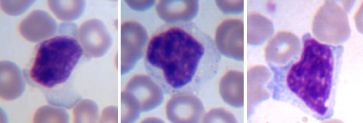
Рис. 2. Реактивные лимфоциты второго типа в мазке периферической крови собак. Окраска по Романовскому-Гимзе. Увеличение 1250х
С учётом различий в содержании реактивных лимфоцитов собак распределили в две группы, о чём более подробно написано в разделе «Результаты». Через два месяца после операции шесть собак из 18 (по три от каждой группы) эвтаназированы с целью морфологического исследования регенерирующего нерва, остальные приняли участие в других экспериментах. Для гистологического исследования иссекали седалищный нерв в пределах оперированного бедра и его ветви (большеберцовый и поверхностный малоберцовый нервы) на голени. После альдегидно-осмиевой фиксации кусочки нервов измельчали, заливали в эпоксидные смолы. Поперечные полутонкие (толщиной 1 мкм) срезы нервов дистальнее уровня швов и соответствующих участков интактных нервов получали на ультратомах фирмы LKB (Швеция) и окрашивали по Уикли. Микроскопию срезов проводили на больших исследовательских микроскопах фирмы «Opton» (Германия), оцифровку и анализ изображений – на аппаратно-программном комплексе «ДиаМорф» (Москва). C каждого нерва оцифровывали 30 полей зрения (увеличение 1250) с изображениями не менее 300 миелинизированных нервных волокон (Mf). Измеряли диаметры волокон (Dmf), их аксонов (Dax), толщину миелина (Lmyel). Используя электронную версию тестовой решетки [1], определяли объёмную плотность нейральных элементов (VVneur). Рассчитывали численные плотности миелинизированных нервных волокон (NAmf) и ядросодержащих профилей леммоцитов в составе нервных волокон (NAnuc), процентную долю нервных волокон с признаками вторичной дегенерации (Deg %). Гипотезы о различиях проверяли с помощью критериев Вилкоксона-Манна-Уитни и Пагуровой в компьютерной программе Attestat, версия 9.3.1 (разработчик И.П.Гайдышев, свидетельство об официальной регистрации Роспатента № 2002611109).
Результаты исследования и их обсуждение
Анализ содержания реактивных лимфоцитов через 3 и 7 суток после операции выявил неоднородность выборки, что заставило распределить исследуемых животных на две группы. У 12 собак из 18 суммарная доля R1+R2 не превышала 20 %, причём доля R2 ≤ R1 (группа 1). У остальных шести собак R2 было значительно больше R1, а сумма R1+R2 варьировала от 27 до 66 % (группа 2). Клиническое наблюдение показало, что группа 2 отличается от группы 1 более выраженной аллодинией и гиперальгезией. В дооперационном периоде и в сроки более 7 суток опыта указанные группы не различались по содержанию реактивных лимфоцитов.
Абсолютное и относительное содержание лимфоцитов у собак обеих групп не выходило за пределы референтных диапазонов, однако дооперационные значения и динамика изменений этих показателей в выделенных группах имела существенные различия (рис. 3). Для группы 1 характерны более высокие дооперационные значения содержания лимфоцитов и умеренно выраженные их колебания в послеоперационном периоде, через одну и четыре недели после операции наблюдаются повышения абсолютного содержания по сравнению с дооперационным уровнем. В группе 2 абсолютное и относительное содержание лимфоцитов в дооперационном периоде имеет меньшие значения, чем в группе 1, а в послеоперационном периоде подвержены значительным колебаниям. Пики абсолютного содержания лимфоцитов в группе 2 наблюдаются через две и пять недель после операции, через шесть недель после операции происходит значительное снижение показателя, а затем следует его прирост до конца опыта.
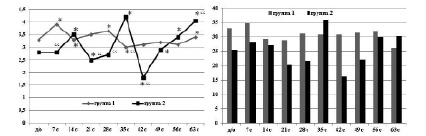
Рис. 3. Динамика изменений содержания лимфоцитов периферической крови. Абсциссы – срок опыта (д/о – до операции, с – сутки опыта). Ординаты: слева – значения абсолютного содержания (в х 109/л), справа – относительного содержания (в процентах): * – статистически значимая разница значения параметра по сравнению с предыдущим сроком опыта; “ – статистически значимая разница между группами (p < 0,05)
Через 9 недель после операции в эндоневрии оперированного седалищного нерва и его ветвей на голени у животных обеих групп обнаружено большое количество регенерирующих миелинизирующихся и безмиелиновых волокон (рис. 4). Наряду с регенерирующими нервными волокнами берцовые нервы содержат значительное количество продуктов валлеровской дегенерации – нагруженных липидными вакуолями макрофагов в эндоневрии и расширенных субпериневральных пространствах, многие периневральные клетки тоже содержат липидные вакуоли. Основное визуальное отличие микропрепаратов животных группы 2 от группы 1 – более часто встречающиеся фигуры аксональной атрофии и вторичной дегенерации нервных волокон. Кроме того в отличие от группы 1 у животных группы 2 вокруг некоторых кровеносных сосудов эпиневрия обнаружены скопления клеток воспалительного ряда (рис. 5). Состояли они главным образом из лимфоцитов, многие из которых были с признаками активации или деления.
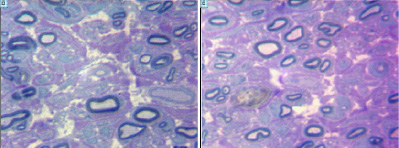
Рис. 4. Фрагменты поперечных полутонких срезов дистального отрезка седалищного нерва через 2 месяца после перерезки и микрохирургического шва. Регенерировавшие безмиелиновые и миелинизирующиеся нервные волокна в эндоневрии. Слева – собака из группы 1, справа – из группы 2. Окраска метиленовым синим-основным фуксином. Увеличение 1250х
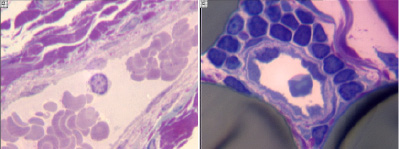
Рис. 5. Фрагменты поперечных полутонких срезов дистального отрезка седалищного нерва через 2 месяца после перерезки и микрохирургического шва. Кровеносные сосуды (вены) в эпиневрии. Слева – собака из группы 1, справа – из группы 2. Окраска метиленовым синим-основным фуксином. Увеличение 1250х
Морфометрический анализ (таблица) показал, что объёмная плотность нейральных элементов в эндоневрии дистального отрезка регенерирующего нерва и численная плотность ядер леммоцитов в составе регенерирующих волокон достоверно больше в группе 2 – на 43,9 % и 30,6 % соответственно, но численная плотность регенерировавших миелинизированных волокон на 13,2 % меньше. Средний диаметр регенерировавших миелинизированных нервных волокон и их аксонов, а также толщина миелиновых оболочек достоверно больше в группе 2 по сравнению с группой 1 – на 12,8 %, 10,9 % и 14,7 % соответственно. Среднее аксо-миелиновое отношение больше в группе 1, а доля вторично дегенерировавших миелинизированных нервных волокон – в группе 2.
Средние стереологические параметры эндоневрия дистального отрезка регенерировавшего нерва и морфометрические показатели миелинизирующихся регенерировавших нервных волокон (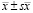 )
)
|
Параметр |
VVneur |
NAnuc |
NAmf |
Dmf |
Dax |
Lmyel |
G |
Deg % |
|
Группа 1 |
37,8 % |
9140 ±920 |
26417 ± 1125 |
3,20 ±0,07 |
1,84 ±0,05 |
0,68 ±0,01 |
0,78 |
1,9 % |
|
Группа 2 |
54,4 %* |
11938* ±848 |
22933* ± 986 |
3,61** ±0,07 |
2,04** ±0,05 |
0,78* ±0,01 |
0,57* |
4,8 %* |
|
Δ % |
+43,9 % |
+30,6 % |
-13,2 % |
+12,8 % |
+10,9 % |
+14,7 % |
-26,9 % |
Cтатистически значимая разница между группами: * – p<0,05; ** – p<0,01.
В результате исследования установлено, что при регенерации седалищного нерва после перерезки и микрохирургического шва у собак наблюдаются два варианта изменений качественного состава и количественного содержания лимфоцитов периферической крови. Различия касаются прежде всего представительства реактивных лимфоцитов в первую неделю после операции. Термин «реактивные лимфоциты» используется для обозначения их доброкачественных трансформаций, которые происходят под влиянием антигенной стимуляции и включают увеличение объёма ядра и цитоплазмы, появление вдавлений ядра, вакуолей, гранул, изменение структуры хроматина и наличие выраженных ядрышек; эти лимфоциты осуществляют первичные либо T-хелперные иммунные реакции в очагах воспаления [9]. Известно, что одни типы хелперов (Th1) опосредуют провоспалительный ответ и неконтролируемые вторичные повреждения тканей, другие (Th2) противодействуют им [8]. Именно последним отводится благотворная роль в нейропротекции и нейрорегенерации [6]. В то же время характер влияния и лимфоцитов, и макрофагов на выживание и регенерацию аксонов различен у животных разных генетических линий [7].
Таким образом, при незначительном представительстве реактивных форм лимфоцитов в первую неделю после операции их общее абсолютное и относительное содержание в периферической крови на протяжении последующих восьми недель меняется незначительно. Если доля реактивных лимфоцитов в первую неделю после операции велика (в данном исследовании 27 % и более), общее содержание лимфоцитов в последующий период наблюдения колеблется в широких пределах. Такие колебания отражают перераспределения лимфоцитов из крови в ткани регенерирующего нерва, поэтому выраженные лимфоцитарные экстравазаты в этой группе животных представляется закономерным. Гистоморфометрический анализ свидетельствовал о более интенсивном глиозе и невротизации дистального отрезка нерва, ускоренной дифференцировке регенерировавших миелинизированных нервных волокон, однако представительство нервных волокон с признаками аксональной атрофии и вторичной дегенерации у таких животных также было большим. С учётом сходства морфологии реактивных лимфоцитов у экспериментальных животных и человека [9] выявленные взаимосвязи могут быть использованы в клинической практике для разработки скрининговых тестов, определяющих показания для углублённого иммунологического обследования и иммунотерапии, направленной на оптимизацию нейрорегенерации.
Заключение
Повышение количества реактивных лимфоцитов в периферической крови в первую неделю после повреждения и шва седалищного нерва у собак ассоциировано с последующими более выраженными колебаниями общего количества лимфоцитов, нейропатическими проявлениями, периваскулярной лимфоцитарной инфильтрацией в эпиневрии, более активной регенерацией и дифференцировкой нервных волокон, но риском истощения компенсаторно-приспособительных возможностей нейронов, о чём свидетельствуют признаки аксональной атрофии и вторичной дегенерации значительной части регенерирующих волокон.



