В настоящее время, во многих развитых странах мира, здоровье человека признается главным богатством страны. Здоровье человека определяет не только его работоспособность, качество и продолжительность жизни, но и пользу для государства.
Современная трактовка понятия «биологические ресурсы» предусматривает сочетание задач сохранения природного флористического фаунистического и ландшафтного разнообразия как основы поддержания глобальных экологических процессов и расширения биоресурсной базы биологических объектов за счет перехода от экстенсивного к интенсивному типу ресурсопользования. Основой этого должна стать замена изъятия биологической продукции из природных популяций разработкой методов создания высокопродуктивных фито-, зоо-, аквакультур ресурсных видов организмов, а так же развитием биотехнологий, оптимизирующих управление ресурсами природных и искусственно созданных биосистем [1, 2].
Ферменты – вещества, ускоряющие химические реакции в живых системах. Первый высокоочищенный фермент уреаза в 1926 году получил ДЖ. Самнер. В течение последующих 10 лет было получено еще несколько ферментов. Ферменты имеют белковую природу, это белковые молекулы или молекулы РНК. Ферменты преобразуют одни вещества в другие, субстраты в продукты. До 2012 года в мире было описано более 5000 ферментов [3, 4, 5].
В кормлении животных и птиц рассматривается роль пищевых ферментов, расщепляющих крупные молекулы корма на мономеры для последующего усвоения в организме. Традиционно различают четыре группы ферментов: протеазы, липазы, целлюлазы, и амилазы.
Протеазы или протеалитические ферменты действуют на зерновые белки и продукты гидролиза белков. Липазы или липолитические ферменты расщепляют жиры на глицерин и жирные кислоты. Амилолитические ферменты (альфаамилаза и бетаамилаза) воздействуют на крахмал, превращая его в декстрины, с образованием мальтозы [6].
С момента первых публикаций Ф. Кликнера и Е. Фолуэлла (1926), об улучшении роста цыплят и повышении яйценоскости кур за счет применения в комбикормах протезима, накоплен большой отечественный и зарубежный опыт по применению ферментов в кормлении птицы.
Однако, система пищеварительных ферментов птицы, вполне справляется с гидролизом основных компонентов корма (белков, жиров, углеводов). Но эффективность собственной ферментной системы снижается при содержании в корме трудногидролизуемых компонентов, а так же при болезнях, некачественных компонентах корма и т.д. (В.И. Фисинин, Т.М. Околелова, И.А. Егоров, В.А. Гейнель, 2009). Большинство промышленных ферментных комплексов отечественного и импортного производства являются продуктом биотехнологий эффективных микроорганизмов, способных вырабатывать те или иные ферменты. Доступность питательных веществ корма под действием таких ферментов действительно увеличивается Т.М. Околелова, А.В. Кулаков, С.А. Молоскин (2001); Е.А. Кончакова (2004); Т.М. Околелова (2000); В.И. Фисинин, И.А. Егоров, Т.М. Околелова, Ш.А. Имангулов (2004); П.Н. Тишенков (1995); В.И. Фисинин, Т.М. Околелова, Д.А. Догадаев, Л.И. Криворучко (2005); В.И. Фисинин, Т.М. Околелова, О.А. Просвирякова, Е.Н. Григорьева (2007).
Но при этом страдает видовое разнообразие микроорганизмов кишечника, лишившихся традиционных питательных субстратов корма.
В ООО «Птицефабрика Бердская» Новосибирской области внедрена «Технология производства функциональных экопродуктов птицеводства» [7].
Согласно технологии, вся промышленная птица не получает лечебные препараты, ферментные комплексы, антибактериальные и противопаразитарные препараты, рыбную муку и кукурузный глютен. Основой рациона являются пшеница, продукты переработки сои и подсолнечника. К основному рациону добавляется молочнокислая кормовая добавка (далее – МКД), основой которой могут быть различные микроорганизмы пробиотики [8, 9, 10, 11].
В научной литературе исследователи часто объясняют полученный от применения пробиотиков эффект, применяя общепринятые свойства пробиотиков, в том числе, наличие в их продуктах жизнедеятельности ферментов. Однако отсутствуют данные об активности ферментных групп как в МКД, так и в сравнении с различными формообразующими микроорганизмами в их составе.
Цель работы – определить наличие ферментных свойств МКД, на основе различных монокультур микроорганизмов пробионтов.
Материалы и методы исследований
Исследования по определению ферментативной активности МКД на основе различных бактерий проводились в четыре этапа. Для исследования были отобраны образцы МКД на основе монокультур-МКД-B (Bifidobacter bifidum longum), МКД-S (Streptococcus termophilus), МКД-P (Propionobacterium acidipropionicum), МКД-L (Lactobacillus acidophilus).
На первом этапе (по ГОСТ 20264.4-89 «Препараты ферментные. Метод определения амилолитической активности») методом Ансона, во всех образцах МКД, определялась суммарная амилолитическая активность. Метод Ансона основан на гидролизе крахмала ферментно-амилолитическим комплексом до декстринов различной молекулярной массы.
На втором этапе (по ГОСТ 20264.2-88 «Препараты ферментные. Методы определения протеалитической активности») определялась суммарная протеалитическая активность в исследуемых образцах. Метод основан на гидролизе белка казеината натрия ферментным комплексом, при рН–7,2. Для определения ПА, нейтральной протеазы, от 0–10 ед\мл, проверены минимальные разведения. Кислая протеаза, определялась при рН–5,5, при которой проходит гидролиз белка.
На третьем этапе (по ТУ9291-008-13684916-05) во всех представленных образцах МКД определялась общая целлюлозолитическая активность. Методика определения целлюлазы основана на определении восстанавливающих сахаров в результате гидролиза целлюлазы хроматографической бумаги под действием фермента. Метод рекомендован международной комиссией ИЮПАК по биотехнологии в качестве основного теста на целлюлазную активность. За единицу эффективности целлюлазы принимают такое количество фермента, которое при действии на хроматографическую бумагу при 50 оС и рН 4,8 образует 1 ммоль восстанавливающих сахаров в 1 мин. Как правило, активность выражается в единицах на миллилитр.
Последним четвертым этапом определения ферментативной активности МКД было определение активности липазы. Метод определения липазы по методике Скермана, основан на определении титрования щелочью жирных кислот, образовавшихся под действием липазы при использовании в качестве субстрата оливкового масла. При определении липазной активности использовалась реакционная смесь, состоящая из 6,5 мл 1\15 М фосфатно-цитратного буфера, 2,5 мл эмульсии оливкового масла в 1%-ном растворе поливинилового спирта в соотношении 2:3 и 1 мл фильтрата культуральной жидкости.
Результаты исследования и их обсуждение
Исследования МКД на основе различных микроорганизмов пробиотиков, показали, что все исследуемые МКД, содержат одну или несколько групп ферментов. Так МКД-B, показала наличие всех исследуемых групп ферментов. МКД-P содержит в своем составе три группы ферментов: амилолитические, протеалитические, целлюлозалитические. В МКД-L обнаружены так же три группы ферментов: протеалитические, целлюлозалитические и липолитические, слабо выражена амилолитическая группа. МКД-S имеет в своем составе две группы ферментов: протеалитическую и целлюлозалитическую, амилолитическая и липолитическая активность выражена слабо.
Результаты исследования ферментативной активности МКД, представлены в таблице.
Ферментативная активность МКД
|
Проба МКД |
Амилолитическая активность (АА), ед\мл |
Протеолитическая активность (ПрА), ед\мл |
Целлюлозолитическая активность (ЦлА), ед\мл |
Липолитическая активность, (ЛА), ед\мл |
|
МКД-L |
---- |
1,0 |
72,4 |
1,4 |
|
МКД-S |
---- |
2,5 |
66,7 |
---- |
|
МКД-B |
11,2 |
2,0 |
66,7 |
12,6 |
|
МКД-P |
9,4 |
7,5 |
64,46 |
---- |
Анализируя данные, полученные в результате исследования ферментативной активности МКД, можно отметить, что все исследуемые монокультуры МКД имеют высокую степень активности целлюлозы (ЦА) от 64,46 ед\мл в МКД-P до 72,4 ед\мл, МКД-L. МКД-S и МКД-B имеют одинаковую активность целлюлозы 66,7 ед\мл.
Все исследуемые нами МКД содержат, кислую протеазу, в которой гидролиз белка осуществляется при рН-5,5. Наибольшая активность протеазы (ПрА) обнаружена в МКД-P – 7,5 ед\мл. Наименьшая ПрА содержится в МКД-L, 1,0 ед\мл. МКД-B имеет значение ПрА 2,0 ед\мл, МКД-S 2,5 ед\мл. Активность липазы (ЛА) определена в МКД-L – 1,4 ед\мл и в МКД-B – 12,6 ед\мл. В МКД-S и МКД-P фермент липаза не обнаружен. Амилолитическая активность (АА) обнаружена в МКД-B – 11,2 ед\мл и в МКД-П- 9,4 ед\мл.
На рис. 1, 2, 3, 4 представлено графическое представление значения ферментативной активности МКД.

Рис. 1. Активность амилазы МКД
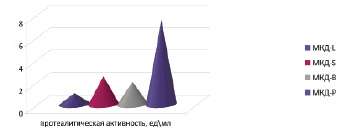
Рис. 2. Протеолитическая активность МКД
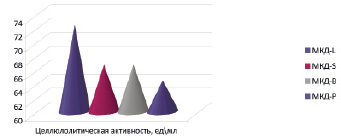
Рис. 3. Целлюлозолитическая активность МКД
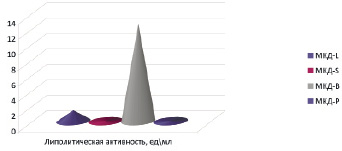
Рис. 4. Липолитическая активность МКД
Данные, полученные в результате исследования ферментативной активности кормовой добавки МКД, на основе различных бактерий, согласуются с литературными о том, что бактерии пробиотики, обладают ферментативной активностью. Наши исследования выявили лидирующие ферментные свойства бифидобактерий в составе МКД, по сравнению с другими исследуемыми микроорганизмами. Различные штаммы бифидобактерий составляют, по некоторым данным, до 90 % представителей нормофлоры кишечника птицы. Бифидобактерии находятся во всех отделах кишечника. Синтезируемые ими все обнаруженные ферментные группы, таким образом, участвуют во всех ферментных процессах при переработке кормов в желудочно-кишечном тракте.
По мнению Хавкина А.И. бифидобактерии принимают активное участие в процессах энзиматического пререваривания кормов, усиливая гидролиз протеинов, сбраживают углеводы, омыляют жиры, растворяют клетчатку [18].
Все исследуемые нами бактерии, в составе МКД показали определенную степень ферментативной активности. Полученные данные свидетельствуют о специфичности уровня и спектра производимых ферментных групп, в зависимости от принадлежности микроорганизмов к определенным видам и условиям жизнедеятельности. Эти данные, в совокупности с остальными характеристиками должны учитываться при разработке различных рекомендаций по применению тех или иных видов пробиотических кормовых добавок.



