Лечение хронического остеомиелита длинных трубчатых костей относится к одной из сложных и актуальных проблем гнойной хирургии [3, 6]. Наиболее частыми возбудителями хронического остеомиелита являются грамположительные кокки рода Staphylococcus spp. с преобладанием штаммов S. aureus, и грамотрицательные микроорганизмы (Escherichia coli, Enterobacter cloacae, Pseudomonas aeruginosa и др.), имеющие более высокую устойчивость к антибактериальным препаратам по сравнению с грамположительными бактериями. Состав микрофлоры при хроническом остеомиелите изменчив и зависит от формы и продолжительности заболевания. Микроорганизмы могут быть представлены как в монокультурах, так и в аэробно-анаэробных ассоциациях, в которых они приобретают новые качества, отсутствующие у составляющих ее видов [4, 5, 6]. Комплекс биологических свойств бактерий-ассоциантов определяет их способность к образованию биопленки, в составе которой микроорганизмы намного устойчивее к неблагоприятным воздействиям и недоступны для фагоцитоза [7, 9], что свидетельствует о большом практическом значении исследований, посвященных этиологической роли микробных сообществ и их биопленкообразующей способности.
Цель работы – изучение биопленкообразующей способности выделенных из ран больных хроническим остеомиелитом штаммов S. aureus и P. aeruginosa и их ассоциаций, полученных in vitro.
Материалы и методы исследования
Исследована биопленкообразующая способность 12 клинических штаммов бактерий, принадлежащих к 2 таксонам (S. aureus – 6, P. aeruginosa – 6), выделенных в ассоциациях (S. aureus + P. aeruginosa – 6) у 6 пациентов с хроническим остеомиелитом длинных трубчатых костей из свищей в дооперационном периоде и из очага воспаления во время операции.
Выделение и идентификацию исследуемых штаммов проводили общепринятыми методами [1].
Адгезивную активность штаммов изучали на модели эритроцитов человека А (ІI) Rh+ по методике В.И. Брилиса [1]. При оценке адгезивных свойств использовали индекс адгезивности микроорганизмов (ИАМ). Исследование проводили под световым микроскопом, учитывая в общей сложности не менее 50 эритроцитов. Микроорганизмы считали неадгезивными при ИАМ – до 1,75; низкоадгезивными – от 1,76 до 2,5; среднеадгезивными – от 2,51 до 4,0; высокоадгезивными – ≥4,1.
Способность к образованию биопленки клиническими штаммами на поверхности 96-луночных полистироловых планшетов проводили по методу G.O. Toole и R. Kolter [8]. По уровню адсорбции красителя этанолом, измеренному в единицах оптической плотности (OD630) на фотометре ELx808 (BioTek, США) при длине волны 630 нм оценивали активность формирования биопленки. Для интерпретации полученных данных определяли способность штаммами формировать биопленки в соответствии с критериями, разработанными Stepanovic S. et al. [10]: при значениях OD630 ниже 0,090 – считали, что штаммы не обладали способностью к образованию биопленки; при 0,090 < OD630 ≤ 0,180 – штаммы обладали слабой; при 0,180 < OD630 ≤ 0,360 – средней; при OD630 ≤ 0,360 – высокой способностью к образованию биопленки.
Для визуальной и количественной оценки способности бактерий формировать биопленки на поверхности покровного стекла использовали стерильные стеклянные чашки Петри диаметром 100 мм. В каждую чашку помещали стерильное покровное стекло размером 24х24 мм, на поверхность которого осторожно наливали 200 мкл суточной культуры штамма с концентрацией клеток 107 кл/мл и помещали в термостат при 37 °С. Через 3 часа добавляли мясопептонный бульон до 2 мл и помещали в термостат при 37 °С. Через 24 и 48 часов после инкубации питательную среду сливали, поверхность стекол трижды промывали 1,15 М фосфатным буфером, фиксировали 96 ° спиртом, высушивали, окрашивали раствором генциан-виолета в течение 2 минут при комнатной температуре, после чего промывали фосфатным буфером.
Ассоциации микроорганизмов in vitro получали путем смешивания суточных культур штаммов в соотношении 1:1 в лунках планшетов и на покровном стекле.
Цифровые изображения полей зрения получали с помощью микроскопа Axio Lab.A1 и модульного программного обеспечения ZEN («Carl Zeiss», Германия). Для определения количественных характеристик использовали программу ImageJ (США). На цифровых изображениях препаратов измеряли площадь поля зрения и площадь, занимаемую единичными адгезированными клетками и микроколониями. Рассчитывали доли единичных адгезированных клеток и микроколоний в площади поля зрения. С каждого препарата вводили не менее 20 случайных полей зрения, полученные результаты усредняли.
Статистическую обработку результатов проводили с помощью программного обеспечения анализа данных AtteStat, версия 13.0 [2]. Значимость различий между группами проверяли с помощью непараметрических критериев Вилкоксона и Манна-Уитни. Различия между группами наблюдений считали статистически значимыми при Р < 0,05.
Результаты исследования и их обсуждение
При определении ИАМ установлено, что штаммы S. aureus обладали низкоадгезивными (2,24 усл. ед.), штаммы P. aeruginosa – среднеадгезивными свойствами (2,50 усл. ед.).
По данным фотометрического анализа наиболее активно биопленку на поверхности 96-луночного полистиролового планшета формировали штаммы P. aeruginosa, о чем свидетельствуют средние значения OD630 (рис. 1). Штаммы S. aureus характеризовались низкой способностью к формированию биопленки, что согласуется с данными адгезивной способности микроорганизмов.
Через 48 ч наблюдали активный рост биопленок по сравнению с контролем, что подтверждается значениями оптической плотности. Интенсивность биопленкообразования ассоциации микроорганизмов (S. aureus + P. aeruginosa) была в 1,6 раза выше по сравнению с уровнем биопленкообразования чистыми культурами исследуемых клинических штаммов.
В отличие от полистирола на поверхности покровного стекла способность к образованию биопленки была более выражена у штаммов S. aureus, о чем свидетельствует доля их микроколоний в площади поля зрения через 24 и 48 часов (рис. 2). В тоже время, у штаммов P. аeruginosа наблюдали более выраженную адгезию единичных клеток, доля которых в площади поля зрения в 3 раза превышала долю единичных адгезированных клеток штаммов S. aureus.
Отмечены различия и в структуре биопленок, определяемой размерами и долей микроколоний в площади поля зрения. Так, через 24 ч в биопленке, образованной штаммами S. aureus на поверхности стекла преобладали микроколонии размером до 10 мкм2, в биопленках штаммов P. аeruginosа и ассоциации микроорганизмов большую часть площади занимали микроколонии размером от 10 до 100 мкм2. Кроме того, в биопленках штаммов P. аeruginosа отсутствовали микроколонии размером от 1000 до 10 000 мкм2, имеющихся в составе биопленок у штаммов S. aureus и ассоциации бактерий.
Через 48 ч происходило уменьшение доли микроколоний, образованных штаммами S. aureus и увеличение доли микроколоний, образованных штаммами P. аeruginosа, способность к образованию биопленки ассоциацией микроорганизмов оставалась прежней, что было связано с изменением соотношения микроколоний различного размера. Так, в биопленках штаммов S. aureus наблюдали уменьшение доли микроколоний всех размеров. В биопленках, образованных штаммами P. аeruginosа, напротив, происходило увеличение долей микроколоний всех размеров и появление микроколоний размером от 1000 до 10 000 мкм2. В биопленках, образованных ассоциацией микроорганизмов (S. aureus + P. aeruginosa) уменьшалась доля микроколоний размером до 100 мкм2 и одновременно, в 3,7 раза, увеличивалась доля микроколоний размером от 1000 до 10 000 мкм2, которые и занимали большую часть поверхности стекла.
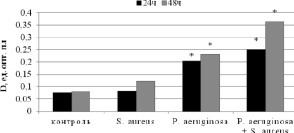
Рис. 1. Изменение средней оптической плотности красителя в лунках полистироловых планшетов, отражающей интенсивность формирования биопленки на их поверхности, штаммами S. aureus и P. аeruginosа и их ассоциациями, полученными in vitro. * Р < 0,001 – различия значимы по сравнению с контролем
Необходимо отметить, что доли микроколоний, образованные чистыми культурами штаммов на данном сроке наблюдения, были меньше доли микроколоний, образованных ассоциацией микроорганизмов.
Известно, что микробные биопленки ответственны за этиологию и патогенез многих острых и хронических бактериальных инфекций у человека, в том числе и при хроническом остеомиелите.
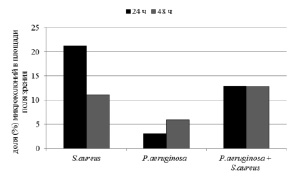
Рис. 2. Соотношение долей микроколоний, образованных штаммами S. aureus и P. аeruginosа и их ассоциациями, полученными in vitro, на поверхности покровного стекла через 24 и 48 часов. * Р < 0,005 – различия значимы по сравнению с предыдущим сроком наблюдения
При формировании биопленок у многих бактерий происходит переключение систем метаболизма от свободноживущего к организованному «общественному» образу жизни (Quorum Sensing), более характерному для многоклеточных микроорганизмов. В составе таких сообществ микроорганизмы приобретают устойчивость к антибактериальным препаратам и факторам иммунной защиты макроорганизма [5, 7, 9].
Выводы
Результаты проведенного исследования показали, что уровень биопленкообразования зависит не только от адгезивной способности штаммов, населяющих биопленку, но и от поверхности, к которой прикрепляются бактерии. Так, несмотря на низкоадгезивные свойства, штаммы S. aureus активно формировали микроколонии на поверхности стекла. Среднеадгезивные штаммы P. aeruginosа обладали более выраженной способностью к образованию микроколоний на поверхности полистиролового планшета. Данный факт свидетельствует о том, что микроорганизмы адаптируются к новым условиям за счет набора вирулентных свойств, определяющих адгезию бактериальных клеток к различным поверхностям. Биопленкообразующая способность ассоциации микроорганизмов: S. aureus + P. aeruginosa, была выше по сравнению с чистыми культурами исследуемых штаммов, что объясняется определенными взаимоотношениями, характер которых зависит от физиологических особенностей и потребностей совместно развивающихся микробов [9]. Cпособность клинических штаммов бактерий формировать биопленки in vitro на поверхности различных носителей, свидетельствует об их возможности колонизировать ткани организма и вызывать хронизацию инфекционного процесса при остеомиелите.
[1] Выполнено м.н.с. Л.В. Розовой и Н.В. Годовых



