Процессы свободнорадикального окисления (СРО) занимают центральное место в метаболизме клетки. Они служат источником энергии, необходимой для жизнедеятельности клетки и всего организма в целом. Эти процессы «готовят» пластический материал для создания и обновления клеточных структур, принимают непосредственное участие в реакциях, связанных с метаболизмом углеводов, липидов, белков.
Процессы свободнорадикального окисления липидов и белков являются одним из важных регуляторов метаболизма углеводов, белков, липидов, нуклеиновых кислот, лежащего в основе пластического и энергетического обеспечения функций клетки и организма в целом. Кроме того, они являются лимитирующим звеном регуляции морфо-функционального состояния биологических мембран, их проницаемости и внутриклеточного гомеостаза. Следует отметить немаловажную роль процессов свободнорадикального окисления в регуляции интенсивности пролиферации клеток, биосинтезе простагландинов и катехоламинов. Все реакции митохондриального и микросомального окисления в результате неполного восстановления кислорода до воды могут образовываться его активные формы: синглетный кислород, супероксидный анион-радикал, гидроксильный радикал, пергидроксильный радикал, перекись водорода. В результате реакций активных форм кислорода прежде всего, с ненасыщенными жирными кислотами, в присутствии ионов металлов переменной валентности образуются так называемые перекисные соединения. В связи с этим весь процесс, имеющий свободнорадикальный характер получил название «свободнорадикального окисления липидов и белков». Реакции СРО, имеющие универсальный характер, являются показателем устойчивости стационарного режима превращений в организме и, оказывая влияние на его адаптивные особенности, определяют возможность развития патологии. Это обусловлено высокой биологической активностью соединений, образующихся в реакциях СРО, комплексом системных перестроек метаболизма, изменениями характера межклеточных и межсистемных взаимоотношений, а также решающей роли в жизнедеятельности биомембран организма, в структуре которых важное место занимают липиды с высоким содержанием ненасыщенных жирных кислот.
Можно выделить несколько форм кислорода и путей их превращения в клетке, играющих основную роль в потенцировании перекисных реакций, определяя их регуляторную и патофизиологическую значимость. Эти формы кислорода образуются в ходе его ступенчатого восстановления. При потере кислородом одного электрона образуется супероксидный анион-радикал (О2–), который может генерироваться при аэробном дыхании в митохондриях вследствие недостаточной эффективности переноса электронов во всех компонентах дыхательной цепи. Генерация супероксидных анион-радикалов в заметных количествах происходит при активации цитохром Р450 – зависимых оксидоредуктаз эндоплазматического ретикулума и функционировании различных мембраносвязанных оксидаз (ксантиноксидаза и др.), на определенных этапах биосинтеза и окисления катехоламинов. Более высокая степень окисления кислорода достигается при взаимодействии супероксидного аниона с протоном. В этой реакции (I стадия) образуется пергидроксильный радикал, являющийся более сильным окислителем, чем супероксидный анион-радикал. На II стадии восстановления молекулярного кислорода образуется перекись водорода, на III – гидроксильный радикал (НО–), характеризующийся очень высокой реакционной способностью и являющийся одним из основных инициаторов реакции СРО. При определенных условиях дисмутация супероксидный анион-радикал может продуцировать еще одну электронно-возбужденную форму кислорода, отличающуюся от основной внутримолекулярной перестройки электронов и имеющую наиболее высокий энергетический уровень, а именно синглетный кислород (1О2), синглетный кислород характеризуется, высокой реакционной и биохимической эффективностью. Его образование сопровождается хемилюминесценцией в видимой области спектра, что позволяет судить о характере превращений активированных форм кислорода в изучаемой системе. Большой вклад в образование активных форм кислорода в организме вносит их генерация клетками системы мононуклеарных фагоцитов. Окисление жирно-кислотных остатков в составе фосфолипидов идет по свободнорадикальному типу. Образующиеся в результате этого гидроперекиси фосфолипидов неустойчивы, происходит их самопроизвольнвй распад, что характеризует СРО как цепной избыточный выраженный многоступенчатый процесс с дополнительными разветвлениями. Такой путь окисления липидов характерен не только для эритроцитарных мембран, но и для различных внутриклеточных мембранных образований (эндоплазматический ретикулум, митохондрии, лизосомы). СРО является типичным цепным процессом с выраженными разветвлениями и протекающим по свободнорадикальному механизму в несколько стадий. При ступенчатой деградации полиненасыщенных липидов в реакциях СРО образуется ряд первичных, вторичных и конечных молекулярных продуктов, играющих важную роль в процессах структурной модификации биомембран и изменений их физико-химических свойств. Поскольку диеновая конъюгация в молекулах полиненасыщенных жирных кислот и их гидроперекиси появляются на самых начальных стадиях СРО липидов, то их относят к первичным продуктам СРО: диеновым конъюгатам и кетодиенам. Аналогом первичных продуктов при СРО белков являются СО-концевые остатки аминокислот. Перекиси липидов – нестойкие вещества и легко распадаются, особенно в присутствии катализаторов – ионов металлов переменной валентности с образованием более устойчивых вторичных продуктов, к которым относят кислородсодержащие соединения: альдегиды и диальдегиды, в частности, малоновый диальдегид, образующийся при СРО липидов. Битирозин (битирозиновые сшивки) – это вторичный продукт СРО белков. Параметры первичных и вторичных продуктов СРО липидов и белков отражают реальную интенсивность процессов СРО.
Оксид азота и его метаболиты в зависимости от системы окислительного метаболизма могут стимулировать окисление, являясь мощными прооксидантами, и в тоже время метаболиты представляют собой механизм эндогенной системы антиоксидантной защиты организма. Эти два процесса, а именно СРО липидов и белков, а так же действие оксида азота и его метаболитов необходимо рассматривать в неразрывной функциональной связи.
Оксид азота – это радикал, который образуется в результате окисления азотсодержащих активных функциональных групп, проявляет прооксидантные свойства и восстанавливается до токсикантов: нитратов и нитритов (см. рис. 1).
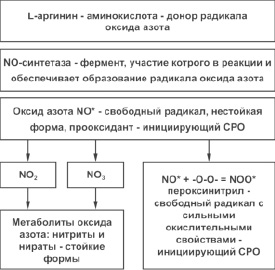
Рис. 1. Система оксида азота и его метаболитов L-аргинин – донор, NO-синтетаза – фермент, оксид азота – нестойкая форма, NO2 и NO3 – стойкие формы, пероксинитрил – свободный радикал
Оксид азота и его метаболиты обладают прооксидантными свойствами, инициируя СРО липидов и белков, и кроме того, в определенных условиях метаболиты оксида азота, реагируя со свободным кислородным радикалом – супероксидным анион-радикалом, образуют токсичные соединения.
Высокая биологическая активность продуктов СРО определяет два противоположных типа их действия в организме. Первичные продукты СРО, концентрация которых в норме невысока, оказывают позитивное действие, заключающееся в обратимых гидрофильно-гидрофобных превращениях жирнокислотных остатков мембранных фосфолипидов с позитивным изменением функционального состояния биомембран и активацией многих мембраносвязывающих ферментов. Вторичные продукты СРО, имеющие, помимо карбоксильной, альдегидные и кетонные группы, оказывают повреждающее действие на структурно-функциональное состояние биомембран.
Поскольку диеновая конъюгация в молекулах полиненасыщенных жирных кислот и их гидроперекиси появляются на начальных стадиях СРО липидов и белков, то их относят к его первичным продуктам. Обладая высокой реакционной способностью, первичные продукты СРО повреждают различные биомолекулы, в первую очередь белки. Повреждающее влияние липидных перекисей и свободных радикалов на белковую молекулу реализуется за счет взаимодействия с группами белков, что является основой их инактивирующего влияния на многие ферменты. Липидные перекиси легко вызывают полимеризацию ферментов, увеличивают скорость потребления кислорода и оказывают разобщающее действие на окислительное фосфорилирование в митохондриях. Первичные продукты СРО оказывают свое разрушительное действие на узловые ферменты, а именно гликолиза и цикла трикарбоновых кислот в дыхательной цепи.
В результате взаимодействия ненасыщенных жирнокислотных остатков фосфолипидов липидного слоя биомемембран с активными формами кислорода образование и накопление гидроперекисей фосфолипидов приводит к увеличению подвижности полипептидной цепи белков. Это сопровождается деформацией мембранного липопротеинового комплекса с повышением проницаемости мембран для протонов и воды, снижением активности мембраносвязанных ферментов. Повышение уровня диеновых коньюгат, кетодиенов и аналогов первичных продуктов СРО белков – СО концевых остатков аминокислот свидетельствует об активации процессов СРО. Избыточность этих продуктов оказывает негативное влияние на функциональное состояние биомембран с их последующей фрагментацией и возможным разрушением. Первичные продукты СРО липидов и белков нестойкие и быстро распадается с образованием вторичных продуктов, а именно малонового диальдегида и битиразина (битиразиновые сшивки). Этот сложный процесс можно представить следующим образом (см. рис. 2).
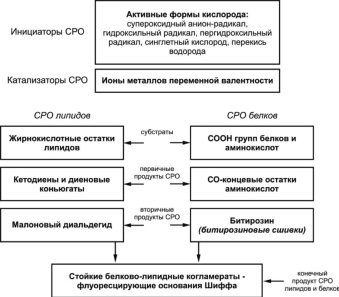
Рис. 2. Схема свободнорадикального окисления липидов и белков. Инициаторы, катализаторы, субстраты, первичные, вторичные и конечные продукты СРО липидов и белков
Перекиси липидов – сравнительно нестойкие веществами и легко подвергаются гомолитическому распаду, особенно в присутствии катализаторов – ионов металлов переменной валентности, с образованием более устойчивых вторичных продуктов СРО липидов и белков. В биологических системах эти продукты обычно находятся в высоких стационарных концентрациях и принимают участие в различных биохимических процессах. Вторичные продукты СРО (кетоны и альдегиды в клетках и тканях) являются субстратами многих цитозольных и микросомальных ферментов. Вторичный продукт СРО липидов – малоновый диальдегид – образуется в результате окислительной модификации углеводородных хвостов молекул липидов и жирных кислот, фактически в результате распада диеновых коньюгат и кетодиенов. Повышение уровня малонового диальдегида свидетельствует об избыточной активации процессов СРО, снижение по сравнению с нормой – об угнетении липидного обмена. Малоновый диальдегид очень токсичен и химически активен.
Вторичные продукты СРО, имеющие, помимо карбоксильной, альдегидные, кетонные и эпоксидные функциональные группы, оказывают повреждающее действие. В первую очередь это связано с нарушением структурно-функционального состояния биомембран. При избыточной активации процессов СРО липидов и белков, когда окислительной деградации подвергается значительные количества мембранных фосфолипидов и основное значение имеет уменьшение количества непредельных фосфолипидов, интегральные белки оказываются как бы «вмороженными» в более ригидную матрицу. При этом изменяет конформационная подвижность полипептидной цепи, необходимая для нормального функционирования ферментов, рецепторов и каналообразующих белков. В результате их функциональная активность ингибируется, в частности нарушается активность Са2+-АТФ-азы и удаление Са2+ из клетки, где и реализуется их повреждающее действие. Накапливающиеся в результате активации СРО окисленные фосфолипиды, образуют упорядоченные группы – так называемые перекисные кластеры, что приводит к образованию гидрофильных пор в гидрофобной области мембраны и увеличению ее проницаемости, в частности, для тех же ионов Са2+. Это может играть важную роль в возникновении их избытка в клетке с реализацией их повреждающего действия. Дальнейшее увеличение количества продуктов СРО и перекисных кластеров может стать основой фрагментации и разрушения биомембран. Увеличение параметров малонового альдегида сопровождается заметным снижением активности глюкозо-6-фосфатазы в эндоплазматическом ретикулуме, а так же различных АТФ-аз и ацетилхолинэстеразы в эритроцитах. В клетках, насыщенных диеновыми конъюгатами наблюдается быстрое падение активности аденилатциклазы, АТФ-азы, глутаматдекарбоксилазы, лактатдегидрогеназы, цитохромоксидазы, сукцинатдегидрогеназы и различных микросомальных оксигеназ. Малоновый диальдегид химически активен и токсичен, оказывает повреждающее действие, связанное с нарушением структурно-функционального состояния биомембран, способствует увеличению их проницаемости для ионов кальция, что может играть важную роль в возникновении избытка ионов кальция в клетке с реализацией его повреждающего действия.
Диальдегиды и ряд других вторичных продуктов СРО липидов и белков (малоновый диальдегид и битиразин) взаимодействуя с N-концевыми остатками аминокислот, белков и аминогруппами фосфолипидов, образуют конъюгированные флуоресцирующие соединения типа оснований Шиффа (ОШ). Эти соединения являются более стабильными или конечными продуктами СРО липидов и белков, так как их утилизация в организме происходит с очень низкой скоростью, в результате чего они накапливаются в тканях организма. Флуоресцирующие продукты СРО – комплексы липопротеидов, входящих в состав известного внутриклеточного образования – липофусцина. Соединения типа ОШ, обладая высокой реакционной способностью, могут производить межмолекулярные «сшивки», а также вступать в реакции полимеризации и поликонденсации. В результате этого биополимеры и биомембраны теряютхарактерные для них функциональные свойства. Увеличение ОШ свидетельствует о тенденции к хронизации избыточной активации СРО липидов и белков.
Таким образом, процессы СРО липидов и белков, являясь важными регуляторами метаболизма и биосинтеза клетки, служат источником энергии, необходимой для жизнедеятельности клетки и всего организма в целом.



