В настоящее время для обеззараживания воды применяется широкий спектр химических реагентов. Самый распространенный и давно применяемый – это «активный хлор», а также вещества, содержащие в своем составе хлор, такие как гипохлорит натрия и кальция, диоксид хлора, хлорамин [4]. Хлор является сильно действующим ядовитым веществом. В случае его утечки существует опасность не только для обслуживающего персонала, но и для населения, проживающего на территории, прилегающей к водоочистному сооружению. Также применяются повышенные требования к перевозке и хранению хлора. Поэтому на сегодняшний день все чаще стали вводить в практику обеззараживания альтернативные хлору химические соединения. Наиболее широкое применение находит гипохлорит натрия – «активный хлор», получаемый на месте потребления электролизом раствора поваренной соли [7, 8].
Целью работы являлось установление влияния исходной концентрации хлорид-ионов в растворе на эффективность протекания процесса электролиза растворов хлорида натрия с целью получения «активного хлора».
Лабораторные исследования по получению электролизного раствора «активного хлора», проводились на электролизере бездиафрагменного типа. Материал анода, используемый в работе электролизера, был выбран нами на основании проведенного анализа литературных источников, которые показали, что для получения хлора и его кислородных соединений электрохимическим наибольшее распространение находят малоизнашивающиеся аноды на титановой основе [1, 2]. В качестве активного покрытия рекомендуются: магнетит, сплавы на серебре, платиново-иридиевые, оксиды железа, свинца, марганца, кобальта и палладия. Но к настоящему времени наибольшее распространение нашли окисно-рутениевые покрытия [5, 6].
Методика проведения эксперимента на лабораторной электролизной установке заключалась в следующем: модельный раствор заливался в электролизер и далее с помощью блока электропитания задавалась необходимая плотность тока на электродах и проводилась электролизная обработка раствора. По окончании процесса электролиза в полученном растворе определяли: концентрацию «активного хлора» в растворах йодометрическим методом; остаточную концентрацию хлорид-ионов в исследуемых растворах методом объемного титрования [3]; рН исследуемых водных систем, на иономере И-160.
При работе электролизера в процессе электролиза растворов хлорида натрия на аноде выделяется [9, 10]:
– молекулярный кислород, в результате разложения гидроксид-ионов и молекул воды:
4ОН ¯ – 4e → 2H2O + О2↑
4 H2O – 4e → 4H+ + О2↑
– молекулярный хлор, при разряде хлорид-ионов, который затем в слабокислой и нейтральной среде гидролизуется, образуя хлорид-ионы и кислородсодержащие соединения хлора – «активный хлор»:
2Cl¯ – 2e → Cl2 ↑
Cl2 + H2O → H+ + Cl¯ + HClO
На катоде в основном происходит образованию молекулярного водорода и гидроксид-ионов в результате разряжения молекул воды и восстановления катионов водорода:
2H2O + 2e → H2 + 2OH¯
2H+ + 2e → H2↑
Наряду с основными реакциями, как на электродах, так и в объеме электролита возможно протекание и побочных реакций, снижающих выход основных веществ по току:
– на аноде разряжение молекул воды и ионов гипохлорита по реакциям:
2H2O – 4e → O2 +4H+
6ClO¯ + 3H2O – 6e → 2ClO3¯ +4Cl- +
+6H+ + 3/2O2↑
– на катоде частичное восстановление ионов гипохлорита до хлорид-иона по реакции:
2ClO¯ + H2O + 2e → 2Cl¯ + 2OH¯
В объеме электролита при повышенных температурах может протекать реакция химического образования хлорат-иона:
3ClO- → ClO3¯ + 2Cl¯
Также необходимо отметить, что при электрохимическом получении растворов гипохлорита натрия из натрий-хлоридных рассолов концентрация в прикатодном слое электролита происходит выпадение трудно растворимых гидроксидов щелочноземельных металлов: Ca2+ + 2OH- → Ca(OH)2,
Mg2+ + 2OH- → Mg(OH)2.
В присутствии бикарбоната выпадает трудно растворимая соль карбоната кальция:
Ca2+ + HCO3- + OH- → CaCO3 + H2O.
Основная часть нерастворимых соединений уносится электролитом из электролизера, но некоторое их количество осаждается на катоде, что приводит к постепенному росту напряжения на электролизере и расхода электроэнергии на получение 1-го кг «активного хлора» (ClO¯) [7].
Исследование влияния исходной концентрации хлорид-ионов в растворе на эффективность протекания процесса электролиза растворов хлорида натрия с целью получения «активного хлора» проводили на модельных растворах с содержанием хлорида натрия: 5 г/дм3 (ССl- = 3150 мг/дм3); 10 г/дм3 (ССl- = 6410 мг/дм3); 20 г/дм3
(ССl- = 12700 мг/дм3).
Рабочая плотность тока на анодах составляла 100, 200 и 300 А/м2; электролизную обработку системы проводили в течение 5 минут. Значения рН исходных необработанных модельных растворов колебались в пределах 3,0 – 4,5, после электрохимической обработки значения рН составляли 6,8 – 7,7.
Полученные результаты эксперимента представлены на рис. 1 и 2.
Зависимости, отображенные на рис. 1 показали, что при равных параметрах режимах работы электролизера, выход по току «активного хлора» с увеличением исходной концентрации хлорида натрия в растворе незначительно возрастает, причем, увеличение концентрации свыше 10 г/дм3 практически не влияет выхода потоку «активного хлора».
Зависимости, представленные на рис. 2, свидетельствуют о том, что увеличение концентрации хлорида натрия в исходном растворе приводит к снижению удельного расхода электроэнергии на получение 1 кг «активного хлора». Причем, изменение исходной концентрации NaCl в растворе от 10 до 20 мг/дм3 незначительно влияет на изменение энергозатрат процесса.
Таким образом, анализ полученных данных позволяет сделать вывод, что процесс электролизного получения гипохлоритных растворов более эффективно протекает при исходной концентрации хлорида натрия 10 г/дм3, при этом концентрация хлоридов в растворе составит
6, 41 г/дм3. Режим работы электролизера можно быть как проточным, так и статическим. При этом необходимо будет предусмотреть введение в технологическую линию дополнительной емкости для хранения полученных растворов.
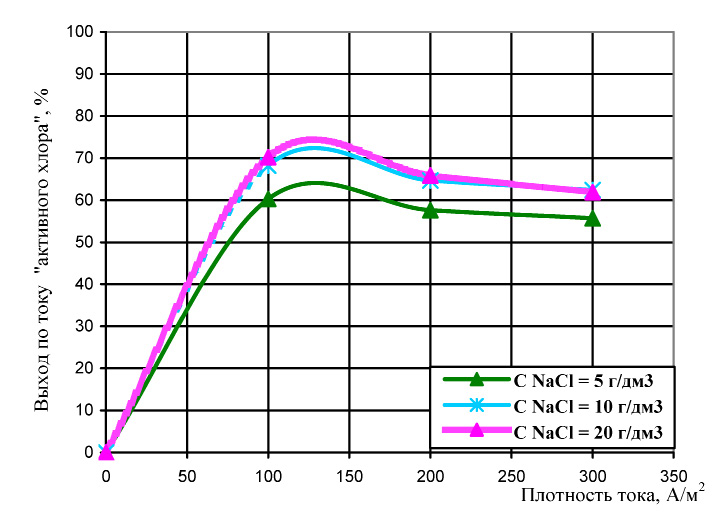
Рис. 1. Влияние исходной концентрации хлорид-ионов на выход по току «активного хлора»
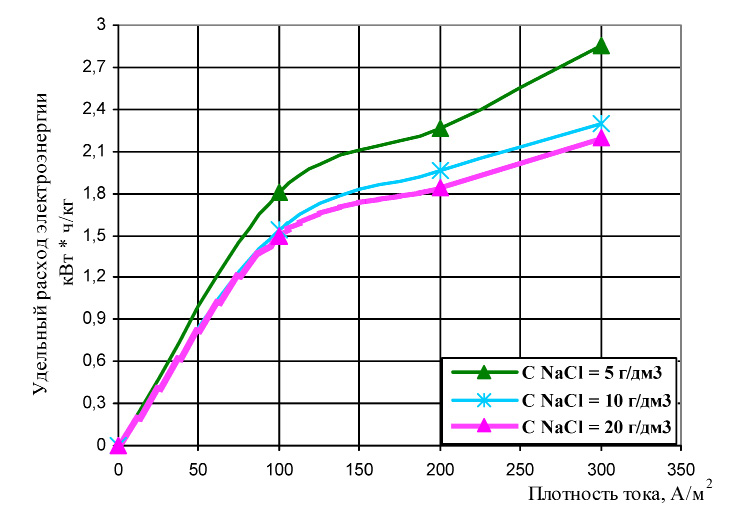
Рис. 2. Влияние исходной концентрации хлорид-ионов на удельный расход электроэнергии



