В настоящее время внимание ученых привлекают естественные источники биологически активных веществ, такие как, левзея сафлоровидная (Rhaponticum carthamoides), серпуха венценосная (Serratula coronata), почки тополя черного (Populus nigra), прополис (Propolis) и т.д. [1].
Экстракты левзеи сафлоровидной используются в нетрадиционной и официальной медицине в качестве тонизирующего средства при функциональных расстройствах нервной системы (включая стрессы), при мышечном утомлении и ослаблении функций разных органов, для терапии и профилактики болезней сердечно-сосудистой системы, онкологических и эндокринных патологий. Их применение рекомендовано для адаптации человека к экстремальным ситуациям, в частности, как средств повышающих силовые качества спортсменов. Левзея сафлоровидная является одним из важнейших источников экдистероидов – биохимических соединений, выполняющих функцию гормоноподобной регуляции физиологических процессов в организме. Являясь по своему химическому строению довольно однородной группой, экдистероиды присутствуют у многих видов животных и растений [1].
Анализ содержания экдистероидов в структуре надземной части левзеи сафлоровидной показал, что наибольшее количество экдистероидов содержится в цветочных корзинках генеративных побегов (0,40 %) и молодых листьях вегетативных побегов (0,43 %). Максимальный выход экдистероидов – до 2,5 кг из 1 тонны сухого растительного сырья можно ожидать при заготовке растений примерно на 30-й день вегетации. Примерами лекарственных препаратов, содержащих экдистероиды, можно назвать настойку левзеи и Экдистен, которые применяются в медицине в качестве адаптогенных средств [2, 3].
Цель и задачи исследований. Цель настоящей работы состояла в разработке инъекционной формы препарата из левзеи, обладающей иммуностимулирующим действием для животных. Для достижения этой цели необходимо было разработать технологию производства препарата, установить его безвредность и иммуностимулирующую активность в опытах на животных.
Материалы и методы исследования
В качестве сырья для наработки Биоинфузина использовали высушенные листья растения левзеи сафлоровидной. Сушка осуществлялась в течение 3-х суток при Т=+30-40°С, в темном, хорошо вентилируемом сушильном шкафу.
Экстракцию проводили 70 % этанолом в течение 10 суток. Супернатант отделяли от исходного материала двухэтапной фильтрацией, с использованием фильтра «владипор». В дальнейшем приготовляли две различные комбинации препаратов: первая представляла из себя этанольный экстракт левзеи в физиологическом растворе, а вторая – дополнительно содержала глюкозу. Фасовка готового препарата проводилась в стерильном боксе, с соблюдением всех правил асептики и антисептики.
Контроль препарата проводили следующим образом. Из общей массы каждой серии Биоинфузина отбирали 10 флаконов по 200 мл. Пять флаконов использовали для анализа, а пять оставляли и хранили 13 месяцев в холодильнике. Один раз в месяц определяли внешний вид препарата, цвет, наличие механических примесей, плесени, стерильность и безвредность на 5 белых мышах, которым вводили внутрибрюшинно 0,5 мл Биоинфузина. Биостимулирующую активность препарата оценивали по изменению массы белых мышей после однократной внутримышечной инъекции в дозе 0,2 мл/мышь.
Лечебно-профилактическая эффективность определялась в научно-производственном опыте на телятах. Идентификацию Биоинфузина осуществляли методом тонкослойной хроматографии на пластинах «Силуфол» 254UV в системе растворителей этанол – вода дистиллированная 4:1. Для этого из наработанной и расфасованной в стеклянные флаконы одной серии препарата микрошприцем брали пробу и наносили на пластины с периодичностью 1 раз в месяц в течение 13 месяцев, просматривали характер флюоресценции в УФ-лучах, сравнивая со стандартным раствором 20-гидроксиэкдизона. Сухой остаток определяли путем упаривания в стеклянном, предварительно взвешенном бюксе при Т=105° С до постоянной массы. Аминокислотный состав Биоинфузина определяли с помощью анализатора ААА-Т-339.
Результаты исследования и их обсуждение
В результате наблюдений на протяжении всего периода эксперимента случаев контаминации микрофлорой какой-либо серии препарата не отмечено, также как и гибели мышей которым его вводили. На протяжении всего периода исследований характер флюоресценции (зеленовато-голубое свечение в УФ-лучах) и величина Rf =0,8 не изменялась. Сухой остаток в препарате находился в пределах 50-65 мг/мл.
Содержание экдистероидов соответствовало 0,0257 %.
Исследования аминокислотного состава опытных образцов препарата, полученного в различных режимах экстракции, показали, что концентрация аминокислот выше в случае экстрагирования сырья 70 % этанолом. Данные приведены в таблице.
Аминокислотный состав опытных образцов биоинфузина в различных режимах экстракции
|
Аминокислоты |
t = 20-25° С (H2O) |
70 % этанол |
||||
|
мг/г СВ |
в % от СП |
в % от Nобщ |
мг/г СВ |
в % от СП |
в % от Nобщ |
|
|
Аспарагиновая |
0,002 |
8.7 |
5.7 |
0,0031 |
10.5 |
6.9 |
|
Треонин |
0,001 |
3.6 |
2.7 |
0,0015 |
5.2 |
3.9 |
|
Серин |
0,0009 |
3.1 |
2.6 |
0,0013 |
4.4 |
3.7 |
|
Глутаминовая |
0,003 |
10.0 |
5.9 |
0,004 |
13.8 |
8.2 |
|
Пролин |
0,002 |
7.1 |
5.5 |
0,002 |
6.6 |
5.0 |
|
Глицин |
0,0012 |
3.9 |
4.6 |
0,0017 |
5.8 |
6.8 |
|
Аланин |
0,0013 |
4.3 |
4.2 |
0,0019 |
6.3 |
6.1 |
|
Цистин |
0 |
0 |
0 |
0,0002 |
0.7 |
0.5 |
|
Валин |
0,001 |
4.2 |
3.1 |
0,0019 |
6.3 |
4.7 |
|
Изолейцин |
0,0008 |
2.8 |
1.9 |
0,0013 |
4.2 |
2.8 |
|
Лейцин |
0,002 |
6.9 |
4.9 |
0,0032 |
10.9 |
7.3 |
|
Тирозин |
0,001 |
3.4 |
1.6 |
0,0012 |
4.1 |
2.0 |
|
Фенилаланин |
0,001 |
3.3 |
1.8 |
0,0015 |
5.0 |
2.7 |
|
Гистидин |
0,004 |
1.4 |
2.4 |
0,004 |
1.2 |
2.1 |
|
Лизин |
0,0018 |
6.0 |
7.2 |
0,0019 |
6.4 |
7.7 |
|
Аргинин |
0,0012 |
4.2 |
8.3 |
0,0016 |
5.5 |
11.0 |
|
Сумма |
0,0242 |
73 |
62 |
0,0289 |
97 |
81 |
Примечание. СВ – сухое вещество; СП – сырой протеин, Nобщ – общий азот.
В дальнейшем приготовляли две различные комбинации препаратов: первая представляла из себя этанольный экстракт левзеи в физиологическом растворе, а вторая – дополнительно содержала глюкозу.
Предварительные испытания двух опытных серий препаратов на белых мышах (5 мышей в группе), которым препарат инъецировали однократно внутримышечно в дозе 0,2 мл/мышь, показали, что вариант с глюкозой увеличивал массу тела белых мышей к 10 дню наблюдений в 1,12 раза больше, чем в случае применения его без глюкозы. В результате остановились на варианте препарата с добавлением глюкозы, которая, как известно, является энергетическим источником и обладает антитоксическим действием (рисунок).
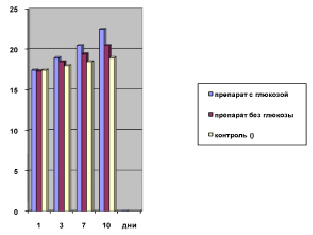
Динамика изменения массы тела белых мышей (г) после применения различных вариантов Биоинфузина
Научно-производственные опыты с препаратом Биоинфузин, проведенные в хозяйствах Кировской области на 350 телятах показали, что препарат наиболее эффективен при внутривенных инъекциях. В сравнении с интактными животными, внутривенная инъекция в дозе 0,75 мг/кг массы тела позволяла снизить заболеваемость телят диареей на 22 %, а респираторными болезнями – на 25 %.
Совместное использование Биоинфузина со средствами симптоматической терапии (антибиотики, витамины и т.д.) позволяло повысить терапевтическую эффективность мероприятий на 15-20 %.
Заключение. В результате проведенных исследований удалось разработать технологию получения препарата Биоинфузин с заданными целевыми свойствами и экологически безопасным процессом его получения, не требующую специального дорогостоящего оборудования. В качестве основного действующего вещества Биоинфузина идентифицирован 20-гидроксиэкдизон.



