В фундаментальных исследованиях последних лет определена особая значимость плацентарного ложа, где происходит имплантация бластоцисты и ее дальнейшее взаимодействие с окружающим эндометрием [4]. В состав плацентарного ложа помимо тканей децидуальной оболочки, содержащей эндометриальные сосуды, пучки миоцитов эндометрия, входят фрагменты якорных ворсин, вневорсинчатый цитотрофобласт, многоядерные гигантские клетки. Интерстиций плацентарного ложа состоит из фибробластов, их длинных отростков, экстрацеллюлярного матрикса и постоянного фибриноидного компонента. Вместе с коллагеном I и III типа они образуют каркас для остальных компонентов плацентарного ложа. Наличие масс фибриноида интерстиция и внутри стенок маточно-плацентарных артерий функциональных артерий функционально активного вневорсинчатого цитотрофобласта указывает на сопряженность процессов инвазии цитотрофобласта и образования фибриноида.
Наиболее существенная функциональная роль тканевых элементов плацентарного ложа заключается в обеспечении иммунологического барьера между плодом и матерью и регуляции инвазии трофобласта в эндометрий. Инвазивный рост в чужеродной ткани вневорсинчатого цитотрофобласта, а также отсутствие отторжения плаценты со стороны материнского организма позволяет объяснить локальную иммунную защиту наличием интерстициального цитотрофобласта и иммунокомпетентных клеток матери: макрофагов и эндометриальных гранулоцитов. Последние образуются из циркулирующих в крови матери мононуклеаров, близких по природе к гранулярным лимфоцитам с характеристикой натуральных киллеров. Им принадлежит важная роль в процессах имплантации и плацентации. Регуляция инвазии трофобластического эпителия осуществляется влиянием компонентами межклеточного вещества (фибронектина, ламинина, коллагена IV типа, интегрина), часть которых синтезируется децидуальными клетками.
Таким образом, плацентарное ложе является уникальным образованием в функциональной системе «мать – плацента –плод», чем объясняется повышенный интерес исследователей к этой зоне матки. Морфологические особенности плацентарного ложа в ранние сроки беременности хорошо изучены. Однако изменения плацентарного ложа при различных патологиях находятся в процессе изучения.
В связи с этим целью нашей работы явилось изучение стереоультраструктуры плацентарного ложа в третьем триместре беременности в норме и на фоне длительного безводного промежутка с применением сканирующей микроскопии.
Для изучения патологических реакций в плацентарном ложе у 10 пациенток, беременность которых в третьем триместре осложнилась длительным безводным промежутком (7–14 суток), был произведен забор участков плацентарного ложа во время операции кесарева сечения. После извлечения ребенка и отделения последа определялась локализация плацентарной площадки. В центре плацентарной площадки производили соскоб эндометрия. С целью контроля подобный материал был взят у 10 пациенток с нормально протекавшей беременностью в аналогичные сроки гестации. Кусочки соскобов размером 1–4 мм фиксировали в формальдегиде с глутаральдегидом по методу Карновского. Затем исследовали в сканирующем электронном микроскопе «Hitachi S-450» при увеличении в 130 и 900 раз.
А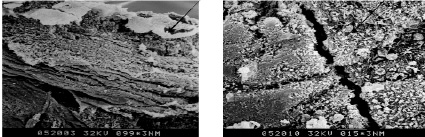 Б
Б
Рис. 1. Электронно-микроскопическое изображение в сканирующем электронном микроскопе Hitachi S-450 эндометрия, контрольная группа. Увеличение на снимке ×130 (А). Стрелкой указан фибриноид. Увеличение на снимке Б ×900. Стрелкой указаны микроворсинки. Хорошо различимо разделение децидуальной ткани на септы: А – Величина маркера 100 мкм; Б – Величина маркера 15 мкм
При исследовании соскобов плацентарного ложа у пациенток с неосложненными беременностью и родами при увеличении в 130 раз (рис. 1, А) определяется характерная структура децидуального слоя. Это достаточно однородная ткань, состоящая из плотно прилегающих клеток. Располагается она в виде «черепицеобразных» пластов. Поверхность децидуальной ткани покрыта невысокими ворсинками, которые некоторые авторы называют щеточной каймой. Децидуальная ткань является местом синтеза и депонирования питательных веществ. Установлено, что децидуальные клетки синтезируют пролактин, аналогичный гипофизарному. Кроме того, в состав децидуальной ткани входят К-клетки, которые выполняют роль иммуносупресоров, предотвращая отторжение плода, и сдерживают инвазию трофобласта за счет киллерной активности. При электронной микроскопии у децидуальных клеток обнаружены фагоцитарные и дезинтоксикационные активности. Децидуальные клетки вырабатывают фактор роста сосудов (VEGF; Vascular endothelial growth factor) – сигнальный белок стимулирующий васкулогенез и ангиогенез, отвечающий за образование эмбриональной сосудистой системы и рост новых сосудов в уже существующей сосудистой системе. Связываясь с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и рецептором-2 VEGF) и активируя их, эти рецепторы экспрессируются клетками эндотелия стенки кровеносных сосудов. Связывание VEGF с этими рецепторами запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию. Эндотелиальные клетки участвуют в таких разнообразных процессах, как вазоконстрикция и вазодилатация, презентация антигенов, а также служат очень важными элементами всех кровеносных сосудов – как капилляров, так и вен или артерий. Таким образом, стимулируя эндотелиальные клетки, VEGF играет центральную роль в процессе ангиогенеза. В то же время стенки части артерий под действием гидролитических ферментов трофобласта подвергаются фибриноидному некрозу, образуя фибриноид. В результате просвет сосудов постоянно зияет, что обеспечивает стабильный и интенсивный кровоток в межворсинчатых пространствах. Фибриноид представляет собой бесклеточный материал, состоящий из продуктов дегенерации клеток, гиалуроновой, сиаловой кислот, иммуноглобулинов, альбуминов. Фибриноид является механическим поддерживающим каркасом, а также иммунологическим барьером. Разновидностью фибриноида, покрывающего базальную децидуальную оболочку, является фибриноид Нитабуха. На снимке А он указан стрелкой и выглядит как белые клубочки ткани. Децидуальная ткань представлена септами, то есть между достаточно компактными участками децидуальной ткани расположены щелевидные пространства, которые обеспечивают укороченный путь маточно-плацентарного кровотока. Размер щелей достигает 8–10 мкм (А). Вся поверхность эпителия густо покрыта щеточной каймой, представляющей собой микроворсинки, которые являются выростами плазматической мембраны, напоминающие морские звезды (снимок Б). Ширина микроворсинок колеблется от 0,5 до 2 мкм. Микроворсинки связаны тонкой перемычкой с апикальной цитоплазмой клеток. Сочетанное использование сканирующей и просвечивающей электронной микроскопии показало, что в этих выростах аккумулируются секреторные продукты, гранулы гликогена, некоторые органеллы [1]. Нередко в состав плацентарного ложа входят фрагменты якорных ворсин, обеспечивающих фиксацию плаценты к стенке матки. По всем полям снимков над слоем децидуальной ткани визуализируются клетки материнской крови: эритроциты, лейкоциты, тромбоциты, а также небольшие островки фибринода. Таким образом, в норме стереоультраструктура плацентарного ложа представляет собой децидуальную ткань, покрытую щеточной каймой, разделенной на септы. На поверхности присутствуют элементы материнской крови. В структуре децидуальной ткани встречаются якорные ворсины.
Для определения значимости длительного безводного промежутка для морфологии плацентарного ложа проведены стереоультраскопические исследования аналогичных структур в основной группе. При исследовании участков плацентарного ложа в основном группе при незначительном увеличении (x130 раз) обращает на себя внимание сглаженность рельефа поверхности децидуальной ткани, который напоминает плато, покрытое фибриновым налетом и клетками крови. На снимке В хорошо просматривается деструкция покрывных микроворсинок, которые потеряли свою звездчатую форму и приобрели округлость очертания. Ширина микроворсинок 2–3 мкм. За счет сморщивания ткани деструктурированные ворсинки располагаются на близком расстоянии. Кузнецов Р.А., Сарыева О.П. экспериментально доказали, что вследствие деструкции ультраструктур клеток децидуальной ткани и эндотелия сосудов плацентарного ложа матки экспрессия сосудисто-эндотелиального фактора роста уменьшается на 13 % по сравнению с показателями при неосложненном течении беременности [2].
Можно предположить, что уменьшение синтеза VEGF эндотелиальными клетками сопровождается задержкой новообразования сосудов в плацентарном ложе и последе, что приводит в свою очередь к нарушению формирования адаптационных процессов со стороны маточного и плацентарного кровотока. В свою очередь развитие дисциркуляторных расстройств влияет на трофику тканей и закладывают основу формирования гипоксии плода.
В Г
Г
Рис. 2. Электронно-микроскопическое изображение в сканирующем электронном микроскопе Hitachi S-450 эндометрия, основная группа. Увеличение на снимке×130 (В). Стрелкой указано повреждение щеточной каймы. Увеличение на снимке×900 (Г). Стрелкой указаны тромбоциты: В – величина маркера 100 мкм; Г – величина маркера 15 мкм
При значительном увеличении x 900 раз (снимок Г) плацентарное ложе представлено пластами децидуальной ткани с явлениями деструкции. Клетки плотно прилегают друг к другу. Нарушена структура септ. Широкие расщелины между слоями клеток плацентарного ложа, размер которых достигает 15 мкм. Щеточный покров уплощен, что свидетельствует о деструкции клеток. По мнению Корниловой Н.К. (2003), ультраструктурная патология щеточной каймы эпителия является одной из основных причин снижения противосвертывающей функции в плаценте и гиперкоагуляции крови в материнском кровотоке, способствуя тем самым преждевременной отслойке нормально расположенной плаценты [3]. Стереоультраскопические исследования позволили выявить признаки локальной гиперкоагуляции в зоне плацентарного ложа при длительном безводном промежутке, которые характеризуются формированием микротромбов с участием эритроцитов и тромбоцитов. Пусковым моментом активизации локальных коагуляционных процессов является воспалительный процесс, о чем свидетельствует присутствие на снимках моноцитов. Моноциты, активизированные эндотоксином и продуктами распада тканей, синтезируют и секретируют регуляторы гемостатического потенциала крови, в частности тканевой тромбоплатстин, К-независимые и К-независимые факторы, а также фибронектин, тромбоспадин, протеогликаны, обеспечивающие процессы адгезии и агрегации тромбоцитов.
Д  Е
Е
Рис. 3. Электронно-микроскопическое изображение в сканирующем электронном микроскопе Hitachi S-450 эндометрия, основная группа. Увеличение на снимках×900 (Д, Е). Стрелкой указан моноцит (снимок Д). Стрелкой указаны сладжированные эритроциты (снимок Е): Д – величина маркера 15 мкм; Е – величина маркера 15 мкм
Освобождение эндотоксинов, ферментов патогенности и вторично избыточное накопление в эритроцитах липопероксидации приводит к дестабилизации эритроцитарных мембран, как один из рассматриваемых вариантов формирования «монетных столбиков» эритроцитов.
Таким образом, при длительном безводном промежутке стереоультраструктура плацентарного ложа имеет признаки воспаления характерные: дистрофические, некробиологические процессы, признаки локальной гиперкоагуляции, которые представлены нарушением структуры децидуальной ткани, уплощением щеточной каймы, расширением щелей между септами, эмиграцией тромбоцитов, лейкоцитов, эритроцитов, агрегацией клеток крови.



