В связи с широкой распространенностью, тяжелым течением с развитием прогрессирующей деструкции хрящевой и костной ткани, ранней инвалидизацией больных ревматоидный артрит (РА) имеет большое общемедицинское и социальное значение, приводя к колоссальным экономическим потерям [3]. Существенно отягощающим проблему РА аспектом является высокая распространенность сердечно-сосудистой патологии и избыточная смертность, обусловленная атеросклеротическим поражением сосудов, при данном заболевании [8]. Принимая во внимание наличие хронического иммунно-воспалительного процесса при РА, приводящего к увеличению содержания в крови белков острой фазы, цитокинов, хемокинов и молекул адгезии [7], перспективным направлением исследований является изучение вклада «болезнь-опосредованных» факторов риска в развитие и прогрессирование ССЗ. Необходимо отметить, что наиболее ранним этапом атерогенеза является эндотелиальная дисфункция (ЭД), одним из наиболее распространенных методов неинвазивной диагностики которой в настоящее время является определение вазомоторной функции эндотелия как в микроциркуляторном русле, так и в сосудах большего калибра [2]. При этом маркеры и механизмы прогрессирования атеросклеротического поражения сосудистого русла при РА в условиях персистирующего аутоиммунного воспаления остаются предметом научных дискуссий, что обусловливает актуальность проведения дальнейших исследований.
Целью исследования явилось изучение связи провоспалительных медиаторов (вч-СРБ, ФНО-α, ИЛ-6 и ИЛ-1β) с показателями функционального состояния эндотелия микро- и макроциркуляторного артериального русла у больных РА без сопутствующей кардиоваскулярной патологии.
Материалы и методы исследования
Обследовано 84 больных с достоверным по критериям ACR (1987) и/или ACR/EULAR (2010) диагнозом РА, длительностью заболевания от 6 месяцев до 5 лет. Средний возраст больных РА составил 39,4 [31, 6; 49,1] лет.
Критерии включения: возраст не моложе 18 и не старше 50 лет, активное течение РА в течение последних 3 месяцев, индекс DAS28 на момент включения в исследование – 3,2 балла и выше, сохраненная способность к самообслуживанию, информированное согласие на участие в исследовании.
Критерии исключения: низкая активность РА (индекс DAS28 менее 3,2 баллов), наличие коморбидной кардиоваскулярной патологии (АГ, любые формы ИБС, ХСН), СД, заболеваний почек (уровень креатинина выше 133 мкмоль/л) и печени (уровень АСТ, АЛТ, билирубина в 3 и более раза превышающие нормальные значения), ожирения (ИМТ более 30кг/м2), прием преднизолона или его эквивалентов внутрь в дозе более 20 мг/сут.
Среди обследованного контингента преобладали женщины (n = 67), внесуставные проявления РА определялись у 68 (80 %) больных, наиболее часто встречались: ревматоидные узелки – у 38 (55 %) больных, амиотрофический синдром – у 49 (72 %) больных, анемия – у 18 (26 %) больных, периферическая нейропатия – у 12 (18 %) больных, капилляриты – у 8 (12 %) больных. Большинство больных РА (n = 61) до включения в исследование получали в качестве БПВП метотрексат (15,0-20,0 мг/ неделю), 32 пациента принимали системные глюкокортикоиды (ГК). У 14 пациентов с РА, включенных в исследование, имел место отягощенный по ССЗ семейный анамнез, умеренный (n = 52) или низкий (n = 18) кардиоваскулярный риск (КВР) при оценке по шкале SCORE.
Все больные РА, включенные в исследование, с учетом иммунологического субтипа и длительности заболевания были рандомизированы на 4 группы: 1-я группа – больные с дительностью РФ/АЦЦП-негативного РА менее 2-х лет (n = 18), 2-я группа – больные с длительностью РФ/АЦЦП-негативного РА более 2-х лет (n = 22), 3-я группа – больные с длительностью РФ/АЦЦП-позитивного РА менее 2-х (n = 24). 4-я группа – больные с длительностью РФ/АЦЦП-позитивного РА более 2-х лет (n = 20).
Группу контроля составили 26 клинически здоровых лиц в возрасте 38,6 [32,1; 47,8] лет (из них 20 (77 %) женщин и 6 (23 %) мужчин).
В ходе исследования у больных РА иммуноферментным методом оценивали уровень IgM РФ и АЦЦП («ORGenTec Diagnostika», Германия). Концентрацию С-реактивного белка (вч СРБ) определяли высокочувствительным иммуноферментным методом («F. Hoffman-LaRoche», Австрия). Содержание в сыворотке крови ФНО-α, ИЛ-1β и ИЛ-6 устанавливали методом твердофазного иммуноферментного анализа с использованием тест-систем ООО «Протеиновый контур» (г. Санкт-Петербург) в соответствии с прилагаемыми инструкциями.
Исследование эндотелиальной функции включало проведение пробы с реактивной гиперемией на аппарате «АнгиоСкан-01» (ООО «АнгиоСкан-Электроникс», Россия) в соответствии с требованиями по подготовке испытуемого и процедуре проведения теста [4].
Статистическая обработка цифровых данных произведена с применением стандартного пакета прикладных программ Microsoft Еxcel и STATISTICA Base for Windows версия 6,0 (StatSoft). Полученные результаты представлены в виде медианы (Ме) с интерквартильным размахом 25–75 процентиль ([25Q;75Q]). Для установления значимости различий между группами применялся непараметрический дисперсионный анализ (ANOVA) по критерию Крускала – Уоллиса. Для оценки взаимосвязи между изучаемыми количественными параметрами применялся метод ранговой корреляции Спирмена (r). Во всех процедурах статистического анализа за критический уровень значимости нулевой статистической гипотезы принимали р = 0,05.
Результаты исследования и их обсуждение
Результаты определения в сыворотке крови уровня провоспалительных цитокинов (ФНО-α, ИЛ-1β и ИЛ-6) при РА показали статистически значимое повышение их концентрации во всех группах обследованных больных в сравнении с контролем, при этом выявлены отличия в их содержании у пациентов с различными клинико-иммунологическими вариантами и длительностью РА (табл. 1). Наиболее высокая концентрация ФНО-α и ИЛ-1β имела место у больных с анамнезом РА менее 2-х лет, которая в 1-ой группе в среднем на 22,6 % (p = 0,028) и 18,2 % (p = 0,016) соответственно была выше этих показателей у больных 2-й группы. Средняя концентрация ФНО-α у пациентов 3-ей группы на 12,6 % (p = 0,046), ИЛ-1β на 10,6 % (p = 0,048) превосходила данные показатели у больных 4-ой группы. При этом более низкий уровень ИЛ-6 определен в сыворотке крови пациентов 1-ой группы, который соответственно на 21,2 % (p = 0,02) и на 23,5 % (p = 0,026) был ниже, чем во 2-ой и 4-ой группах обследованных. Следует подчеркнуть, что наибольший уровень ФНО-α (206,1 [168,3; 248,4] пг/мл, р = 0,001) и ИЛ-1β (164,7 [140,3; 180,1] пг/мл, р = 0,001) имел место у больных 1-ой группы; при этом максимальная концентрация ИЛ-6 (234,6 [212,3; 288,1] пг/мл, р = 0,001) отмечалась у больных 4-й группы.
Выполненный корреляционный анализ показал наличие взаимосвязей между уровнем провоспалительных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6), длительностью (r = 0,61, p = 0,001; r = 0,54, p = 0,01 и r = 0,88, p = 0,008 соответственно) и активностью РА (индекс DAS 28) (r = 0,62, p = 0,001; r = 0,56, p = 0,04 и r = 0,64, p = 0,01 соответственно). Кроме того, выявлено наличие прямых связей между уровнем ИЛ-6 и концентрацией РФ и АЦЦП (r = 0,54, p = 0,022 и r = 0,61, p = 0,018 соответственно); обратная зависимость имела место между концентрацией ФНО-α, уровнем РФ и АЦЦП (r = –0,48, p = 0,039 и r = –0,62, p = 0,01).
Определенные в нашем исследовании различия в содержании провоспалительных цитокинов у больных РА во многом обусловлены их свойствами, установленными в экспериментальных моделях, показавших, что ФНО-α и ИЛ-1β принадлежит ведущая роль в развитии острого воспалительного процесса в суставе, пролиферации синовиальных клеток и формировании паннуса, при этом ИЛ-6 способствует хронизации процесса, стимулируя остеокластогенез, деструкцию костной и хрящевой ткани, и, как следствие, прогрессированию заболевания [6].
Таблица 1
Содержание провоспалительных цитокинов в сыворотке крови больных РА
|
Группа обследованных |
№ п/п |
Показатель |
|||||
|
ФНО-α, пг/мл |
ИЛ-1β, пг/мл |
ИЛ-6, пг/мл |
|||||
|
Контроль (n = 24) |
1 |
34,3 [16,3; 41,1] |
р1-2 = 0,001 р1-3 = 0,008 р2-3 = 0,028 р1-4 = 0,001 р1-5 = 0,012 р4-5 = 0,046
|
28,9 [4,07; 30,2] |
р1-2 = 0,001 р1-3 = 0,004 р2-3 = 0,016 р1-4 = 0,001 р1-5 = 0,004 р4-5 = 0,048
|
8,78 [4,13; 30,47] |
р1-2 = 0,005 р1-3 = 0,001 р2-3 = 0,02 р1-4 = 0,008 р1-5 = 0,001 р4-5 = 0,026
|
|
1-я группа (n = 18) |
2 |
206,1 [168,3; 248,4] |
164,7 [140,3; 180,1] |
136,5 [121,6; 161,8] |
|||
|
2-я группа (n = 22) |
3 |
146,4 [109,7; 204,6] |
116,3 [98,5; 146,8] |
177,3 [140,8; 208,6] |
|||
|
3-я группа (n = 24) |
4 |
168,6 [150,7; 183,4] |
148,2 [130,4; 168,2] |
183,4 [169,1; 201,5] |
|||
|
4-я группа (n = 20) |
5 |
142,3 [119,2; 182,7] |
135,7 [116,3; 158,6] |
234,6 [212,3; 288,1] |
|||
Примечание. Здесь и далее полученные результаты представлены в виде медианы (Ме) с интерквартильным размахом 25–75 процентиль ([25Q; 75Q]), статистическую значимость определяли с помощью ДА (ANOVA) по критерию Крускала – Уоллиса, разницу показателей считали статистически значимой при р < 0,05.
Определение уровня вч-СРБ в сыворотке крови больных с серонегативным по РФ/АЦЦП РА показало значимо большую концентрацию вч-СРБ во 2-ой группе, которая в среднем на 28,6 % (р = 0,05) превышала его содержание у больных 1-ой группы (рис. 1). При этом в 4-ой группе обследованных уровень вч-СРБ был выше показателей 2-ой и 3-ей групп в 1,3 раза (р = 0,05) и в 1,6 раза (р = 0,001) соответственно.
Известно, что вч-СРБ является одним из основных маркеров воспаления, при этом ведущими факторами, стимулирующими его образование, наряду с ИЛ-6 являются ИЛ-1β, ФНО-α, что косвенно подтверждается установленными в нашей работе корреляционными связями между данными медиаторами (r = 0,68, p = 0,02; r = 0,49, p = 0,05; r = 0,53, p = 0,042 соответственно). Так же определена прямая корреляция между уровнем вч-СРБ и индексом DAS28 (r = 0,78, p < 0,0001); вч-СРБ и концентрацией IgM РФ, АЦЦП (r = 0,52, p = 0,02; r = 0,61, p = 0,05 соответственно).
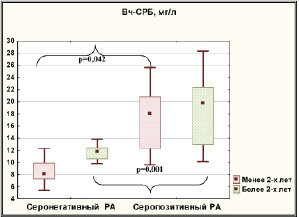
Концентрация вч-СРБ в сыворотке крови больных РА в зависимости от клинико-иммунологического варианта и длительности заболевания
Сравнительная оценка показателей вазомоторной функции эндотелия у больных РА показала снижение индекса окклюзии по амплитуде по сравнению с контролем в 1-ой группе в среднем на 25,7 % (р = 0,04) и на 46,3 % (р = 0,01) во 2-ой группе (табл. 2). Надо отметить отсутствие статистически значимой разницы между данными показателями в группах больных с различной длительностью РФ/АЦЦП-серонегативного РА (р = 0,068). Результаты окклюзионной пробы выявили более низкую величину сдвига фаз между каналами у больных 1-й и 2-й групп в сравнении с контролем в среднем в 1,4 раза (р = 0,036) и в 1,7 раза (р = 0,008) соответственно.
Таблица 2
Параметры окклюзионной пробы у больных РА
|
Группа обследованных |
№ п/п |
Показатель |
|||
|
Индекс окклюзии по амплитуде |
Сдвиг фаз между каналами, мс |
||||
|
Контроль (n = 24) |
1 |
2,1 [1,8; 2,3] |
р1-2 = 0,04 р1-3 = 0,01 р2-3 = 0,068 р1-4 = 0,03 р1-5 = 0,01 р4-5 = 0,08 р2-4 = 0,001 р3-5 = 0,008 |
11,2 [8,1; 15,4] |
р1-2 = 0,036 р1-3 = 0,008 р2-3 = 0,055 р1-4 = 0,008 р1-5 = 0,001 р4-5 = 0,04 р2-4 = 0,001 р3-5 = 0,008 |
|
1-я группа (n = 18) |
2 |
1,55 [1,3; 1,8] |
8,0 [5,7; 9,9] |
||
|
2-я группа (n = 22) |
3 |
1,4 [1,2; 1,8] |
6,8 [4,1; 9,3] |
||
|
3-я группа (n = 24) |
4 |
1,4 [1,1; 1,7] |
1,2 [0,9; 1,6] |
||
|
4-я группа (n = 20) |
5 |
7,1 [5,7; 8,7] |
4,9 [1,6; 7,8] |
||
При РФ/АЦЦП-серопозитивном РА также было выявлено снижение индекса окклюзии по амплитуде, причем у больных 3-ей группы этот показатель был ниже в среднем на 34,6 % (р = 0,03), а в 4-ой группе – на 42,3 % (р = 0,01) в сравнении с контрольным. При серопозитивном варианте РА величина сдвига фаз между каналами у больных 4-й группы была более чем в 3 раза (р = 0,001) ниже контрольной; в 3-ей группе пациентов её значение было на 30,8 % (р = 0,04) меньше контроля. Установлены взаимосвязи между длительностью РА, индексом окклюзии по амплитуде (r = – 0,53, p = 0,01) и показателем сдвига фаз по каналам (r = – 0,42, p = 0,022); обратные зависимости были определены между индексом окклюзии по амплитуде и DAS28 (r = – 0,68, p = 0,01); между показателем сдвига фаз по каналам и уровнем IgM РФ (r = – 0,52, p = 0,01).
Полученные данные свидетельствуют о наличии у больных РА без ССЗ вазомоторной дисфункции эндотелия, как в системе мелких резистивных сосудов (снижение индекса окклюзии по амплитуде менее 2,0), так и в крупных мышечных артериях (уменьшение величины сдвига фаз между каналами менее 10 мс) уже при ранних стадиях заболевания.
Проведенный корреляционный анализ выявил обратные зависимости между уровнем провоспалительных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6) и характеристиками вазомоторной функции эндотелия: индексом окклюзии по амплитуде (r = – 0,64, p < 0,001; r = – 0,56, p < 0,01; r = – 0,66, p < 0,001 соответственно) и величиной сдвига фаз между каналами (r = – 0,48, p < 0,01; r = – 0,52, p < 0,01; r = – 0,64, p < 0,01 соответственно. Таким образом, ФНО-α, ИЛ-1β потенцируют развитие вазомоторной дисфункции эндотелия преимущественно в системе мелких резистивных сосудов, в основном за счет локальных эффектов провоспалительных цитокинов на сосудистую стенку, включающего гиперэкспрессию молекул адгезии на поверхности эндотелиоцитов с развитием воспалительной инфильтрации, что приводит к активации системы свертывания крови и усиливает тромбогенную и вазоконстрикторную активность эндотелия [9].
В свою очередь ИЛ-6 путем активации эндотелиальных клеток, пролиферации и миграции гладкомышечных клеток [5], усиливает продукцию и агрегацию тромбоцитов, повышает секрецию СРБ, транскрипцию гена фактора VIII, экспрессию поверхностного тканевого фактора моноцитами, уровень циркулирующего фактора Виллебранда и снижает концентрацию протеина S и антитромбина [1], обусловливая тем самым прогрессирование микро- и макроциркуляторной дисфункции эндотелия.
Также выявлены обратные корреляционные зависимости между концентрацией вч-СРБ, индексом окклюзии по амплитуде и величиной сдвига фаз между каналами (r = – 0,54, p < 0,05 и r = – 0,68, p < 0,001 соответственно). Известно, что данный медиатор участвует в активации гладкомышечных клеток и сосудов, уменьшает образование NO, что приводит к нарушению вазореактивности эндотелия и запускает проатерогенные, провоспалительные и прокоагуляционные эффекты в сосудистом эндотелии [9]. Указанные механизмы лежат в основе самоподдержания и хронизации воспаления в эндотелии сосудистого русла, прогрессирования ЭД при РА.
Заключение
Таким образом, полученные результаты свидетельствуют, что гиперпродукция ФНО-α и ИЛ-1β на ранних стадиях РА индуцирует дисфункцию эндотелия преимущественно на микроциркуляторном уровне, в то время как избыточный синтез ИЛ-6 и вч-СРБ по мере прогрессирования заболевания потенцирует развитие макрососудистой эндотелиальной дисфункции, в большей степени при РФ/АЦЦП-серопозитивном субтипе.



